Кожные и подкожные новообразования у мелких домашних млекопитающих — ретроспективный анализ 256 случаев (2014–2021)
Аннотация
Поскольку мелкие млекопитающие приобретают всё большую популярность в качестве домашних животных в Польше, количество образцов опухолей, направляемых на гистопатологическое исследование, достаточно велико.
В данном исследовании был проведён ретроспективный анализ кожных и подкожных опухолей у мелких домашних животных, поступивших на гистопатологическое исследование в период с 2014 по 2021 год.
В анализ включены 256 опухолей, отобранных у 103 морских свинок, 53 крыс, 43 домашних кроликов, 21 хорька, 17 хомяков, 8 дегу, 5 африканских карликовых ежей, 3 монгольских песчанок и 3 шиншилл. Диагностика опухолей проводилась методом стандартной гистопатологии с дополнительным иммуногистохимическим исследованием при необходимости.
Результаты исследования показали, что подавляющее количество кожных опухолей у морских свинок носили доброкачественный характер, с преобладанием липом. Опухоли кожных придатков составляли значительную долю среди кожных новообразований у морских свинок (24.3%, наиболее часто встречалась трихофолликулома), домашних кроликов (46.5%, наиболее часто встречалась трихобластома), хорьков (33.3%, преимущественно опухоли сальных желез), хомяков (52.9%, наиболее часто встречалась трихоэпителиома) и песчанок (66.7%, эпителиома пахучих желез).
Саркомы мягких тканей преобладали среди опухолей у крыс (52.8%, наиболее часто встречалась фибросаркома), африканских карликовых ежей (100%), дегу (87.5%) и шиншилл (66.7%). Меланоцитарные опухоли встречались лишь в единичных случаях у мелких домашних млекопитающих. Тучноклеточные опухоли были диагностированы только у хорьков, тогда как эпителиотропная Т-клеточная лимфома выявлена только у хомяка и дегу.
В заключение следует отметить, что злокачественные опухоли составляют значительную долю кожных новообразований у многих видов мелких домашних животных. В связи с этим, каждое кожное новообразование должно быть подвергнуто биопсии для последующей цитологической или гистопатологической диагностики.
Введение
Мелкие млекопитающие обычно используются в лабораторных исследованиях, а также набирают всё большую популярность в качестве домашних животных-компаньонов. В последние годы также наблюдается рост частоты спонтанных неопластических заболеваний у этих животных. Таким образом, внимание было уделено необходимости разработки диагностических, терапевтических и профилактических методов в онкологии мелких млекопитающих.
Для разработки и выявления прогностических и предиктивных факторов для терапии онкологических заболеваний необходимо понимать природу и характеристики неопластических поражений у мелких млекопитающих. Кроме того, мелкие млекопитающие, как и другие домашние и дикие животные, подвергаются тем же экологическим канцерогенным факторам риска, что и люди, и могут использоваться в качестве индикаторов для охраны окружающей среды и общественного здоровья [1].
Таким образом, знания об опухолях у мелких домашних млекопитающих динамично развиваются, и недавние исследования показали, что кожные и подкожные опухоли составляют значительный процент всех опухолей, диагностированных у морских свинок, песчанок [2], домашних кроликов [3], африканских карликовых ежей [4] и хорьков [5].
Однако, несмотря на многочисленные исследования, данные о частоте возникновения определённых типов кожных и подкожных опухолей у мелких млекопитающих домашних животных различаются и, по-видимому, меняются с течением времени [2,3,4,6,7,8].
Сообщения о кожных и подкожных опухолях у домашних крыс, песчанок, хомяков, дегу и шиншилл были довольно скудными. Поэтому важно обновлять данные, имеющие важное значение для надлежащего клинического ведения и онкологической помощи мелким млекопитающим.
Целью данного ретроспективного исследования был анализ частоты кожных и подкожных опухолей у различных видов мелких домашних млекопитающих, включая морских свинок, крыс, домашних кроликов, хорьков, хомяков, дегу, африканских карликовых ежей, монгольских песчанок и шиншилл, представленных на гистопатологию на кафедру патологической анатомии факультета ветеринарной медицины Варминско-Мазурского университета в Ольштыне (Польша). Кроме того, была проведена оценка частоты отдельных видов новообразований в зависимости от пола и возраста животных.
Материалы и методы
В ретроспективный анализ в период с 2014 по 2021 год было включено 256 образцов кожных опухолей, полученных путём эксцизионной или инцизионной биопсии от следующих млекопитающих:
• 103 морских свинок (Cavia porcellus);
• 53 крыс (Rattus norvegicus domestica);
• 43 кроликов (Oryctolagus cuniculus domesticus);
• 21 хорька (Mustela putorius furo);
• 17 хомяков (7 джунгарских – Phodopus sungorus, 7 золотистых – Mesocricetus auratus, 1 предкавказский – Mesocricetus raddei и 2 без указания вида);
• 8 дегу (Octodon degus);
• 5 африканских карликовых ежей (Atelerix albiventris);
• 3 монгольских песчанок (Meriones unguiculatus);
• 3 шиншилл (Chinchilla lanigera).
Образцы хранятся в архиве кафедры патологической анатомии, факультета ветеринарной медицины, Варминско-Мазурского университета в Ольштыне.
Опухоли молочной железы были исключены из исследования. Образцы ткани фиксировали в 10% забуференном формалине, заливали в парафин и разрезали на срезы толщиной 3 мкм. Срезы обрабатывали обычным образом и окрашивали гематоксилином Майера и эозином (HE). При слабодифференцированных саркомах и лимфомах применяли дополнительное иммуногистохимическое исследование. Извлечение антигена проводили в PT-Link (Dako, Glostrup, Дания) с использованием буфера Трис-ЭДТА с pH = 9. Иммуногистохимическое исследование проводили вручную с использованием соответствующих первичных антител, собранных в Таблице 1, и системы визуализации на основе иммунопероксидазного метода с 3,3-диаминобензидином (DAB) в качестве субстрата. Слайды контрастно окрашивали гематоксилином Майера. Положительные и отрицательные контрольные слайды обрабатывались вместе с оцениваемыми секциями. Реактивность антител в тканях мелких млекопитающих суммирована в Таблице 2.
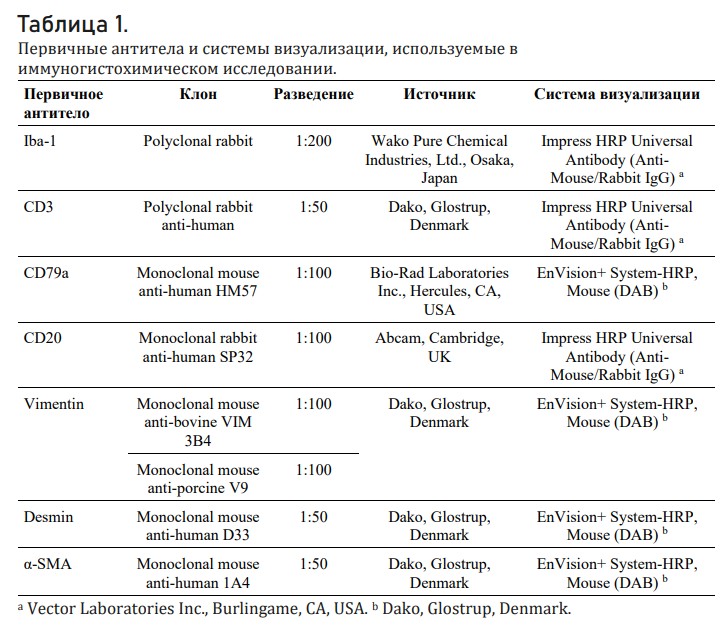
Таблица 1. Первичные антитела и системы визуализации, используемые в иммуногистохимическом исследовании.
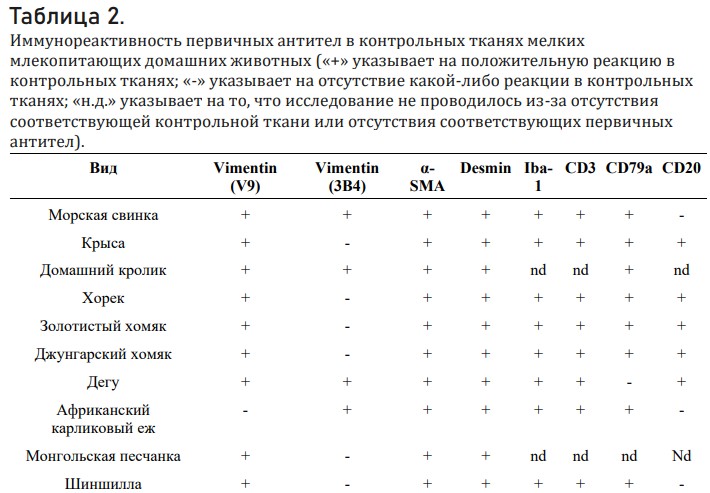
Таблица 2. Суммированная реактивность антител в тканях мелких млекопитающих
Результаты
Морские свинки
Средний возраст поражённых морских свинок составил 3,5 года (возрастной диапазон: 8 месяцев – 9 лет), из них 54 самки, 47 самцов и двое с неуказанным полом. Опухоли мягких тканей составляли подавляющее большинство кожных опухолей у морских свинок (76 случаев) и были получены в основном из адипоцитов или фибробластов.
Наиболее часто встречающейся опухолью была липома (46 случаев), включая 40 случаев простой липомы (26 – одиночные; 14 – множественные), четыре случая фибролипомы и два случая инфильтративной липомы.
Наиболее распространённой локализацией липом была паховая область (16/26 случаев простой липомы), другие локализации включали туловище, шею, подмышечную впадину и голову.
Другие опухоли мягких тканей включали 13 случаев фибросаркомы, девять случаев липосаркомы (восемь – одиночных; один – множественных), три случая фибромы, два случая гемангиомы (капиллярной и смешанного капиллярно-кавернозного типа) и по одному случаю каждой из следующих опухолей: гемангиосаркомы, опухоли периваскулярной стенки и низкодифференцированной саркомы.
В низкодифференцированной саркоме опухолевые клетки экспрессировали виментин (клон 3B4), но были отрицательными по Iba-1, α-SMA и десмину. После липом второй по частоте группой опухолей были доброкачественные опухоли придатков кожи (23 случая) с преобладанием трихофолликуломы (15 случаев), за которой следовала трихоэпителиома (семь случаев, шесть одиночных и один множественный) и один случай аденомы сальных желез. Также были зарегистрированы единичные случаи эпителиоматозной карциномы сальных желез, апокриновой аденокарциномы, плоскоклеточной карциномы и сложной меланоцитомы.
Крысы
Средний возраст поражённых крыс составил 21,9 месяца (возрастной диапазон: 6–36 месяцев), из них 38 самцов, 14 самок и одна с неуказанным полом. Саркомы мягких тканей составили подавляющее большинство проанализированных опухолей (28 случаев), представленных фибросаркомой (15 случаев), слабодифференцированной саркомой (пять случаев), опухолью периваскулярной стенки (четыре случая), миксосаркомой (два случая) и злокачественной опухолью оболочки периферического нерва (два случая).
В двух слабодифференцированных саркомах опухолевые клетки экспрессировали Iba-1 и виментин (клон V9) и были отрицательными по десмину и α-SMA, поэтому они были переклассифицированы как гистиоцитарные саркомы (рисунок 1).
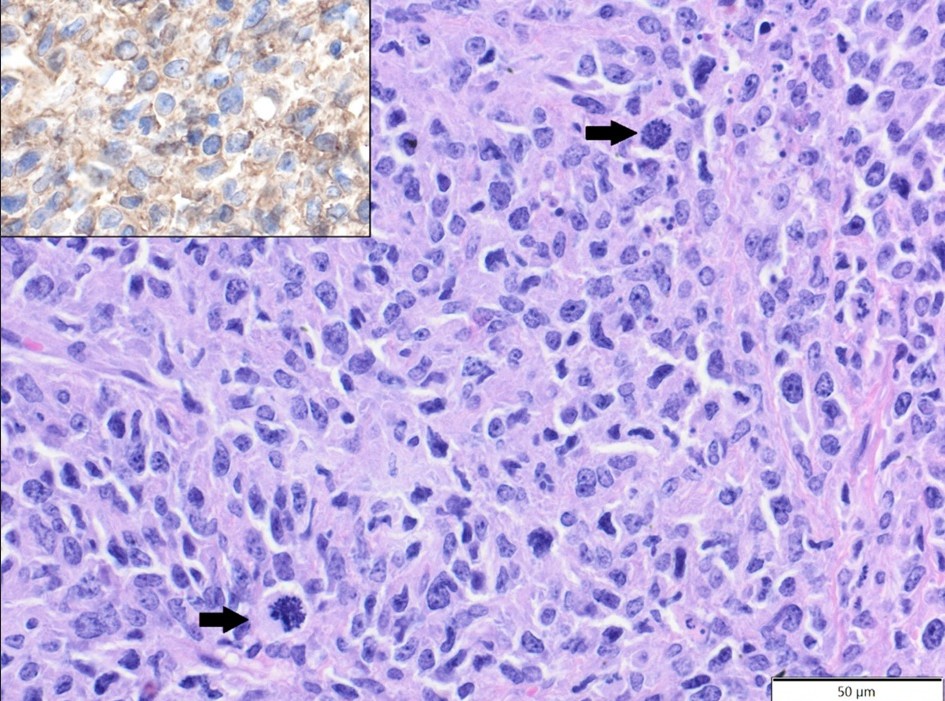
Рисунок 1. Гистиоцитарная саркома, подчелюстная область, крыса. Плеоморфные опухолевые клетки расположены хаотично и показывают митотические фигуры (стрелки). HE. Вставка: опухолевые клетки экспрессируют Iba-1. IHC.
В трёх оставшихся плохо дифференцированных саркомах опухолевые клетки экспрессировали виментин (клон V9) и были отрицательными по Iba-1, десмину и α-SMA, поэтому они были классифицированы как плеоморфные фибросаркомы, согласно Гривзу и др. [9].
Доброкачественные опухоли мягких тканей встречались реже и были представлены фибромой (девять случаев, восемь одиночных и один множественный), простой липомой (два случая) и единичными случаями доброкачественной опухоли оболочки периферического нерва и нейрофибромы.
Плоскоклеточный рак (восемь случаев) составлял большинство эпителиальных опухолей, в то время как доброкачественные опухоли придатков были представлены единичными случаями сальной аденомы, апокриновой протоковой аденомы (солидно-кистозного типа) и пиломатрикомы. Также был один случай меланоцитомы.
Кролики
Средний возраст поражённых кроликов составил 6,1 года (возрастной диапазон: 1–12 лет): 27 были самцами, 14 самками и двое были неуточненными.
Наиболее распространённой кожной опухолью у домашних кроликов была трихобластома трабекулярного типа (18 случаев, 17 одиночных, один множественный), за которой следовала фибросаркома (семь случаев).
Другие эпителиальные опухоли включали два случая плоскоклеточного рака и по одному случаю каждого из следующих: апокринная аденокарцинома, базальноклеточная карцинома, трихоэпителиома и папиллома.
Другие опухоли мягких тканей включали три случая липомы (две простые липомы и одна фибролипома), три случая фибромы и по одному случаю каждого из следующих: доброкачественная опухоль оболочки периферического нерва, злокачественная опухоль оболочки периферического нерва и гемангиома (воспалительный дольковый капиллярный тип). Меланоцитарные опухоли были представлены двумя случаями меланомы и одним случаем сложной меланоцитомы (рисунок 2).
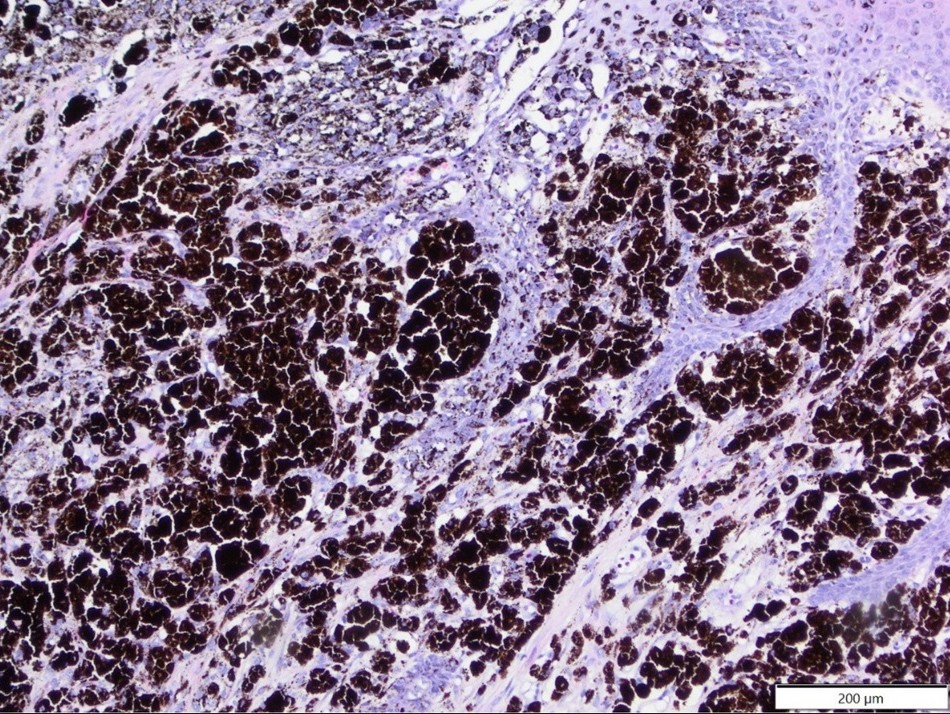
Рисунок 2. Сложная меланоцитома, лицевая область, домашний кролик. Сильно меланизированные, хорошо дифференцированные опухолевые клетки образовали сплошные пласты и массивно инфильтрировали эпидермис. HE.
Хорьки
Средний возраст пострадавших хорьков составил 4,6 года (возрастной диапазон: 1,5–8 лет; самцы: 15; самки: 5; неуточненный: 1).
Наиболее распространённой кожной опухолью у хорьков была опухоль тучных клеток (семь случаев), за которой следовали плоскоклеточный рак (четыре случая) и эпителиома сальных желез (четыре случая). У одного из хорьков с опухолями тучных клеток новая опухоль развилась через несколько месяцев после первой операции.
Другие типы опухолей включали два случая плохо дифференцированных сарком (локализованных в паховой области и у основания хвоста) и отдельные случаи карциномы сальных желез, секреторной апокриновой аденомы, апокриновой аденокарциномы и злокачественной опухоли оболочки периферического нерва. В слабодифференцированных саркомах опухолевые клетки экспрессировали виментин (клон V9) и α-SMA и были отрицательными по Iba-1 и десмину (рисунок 3).
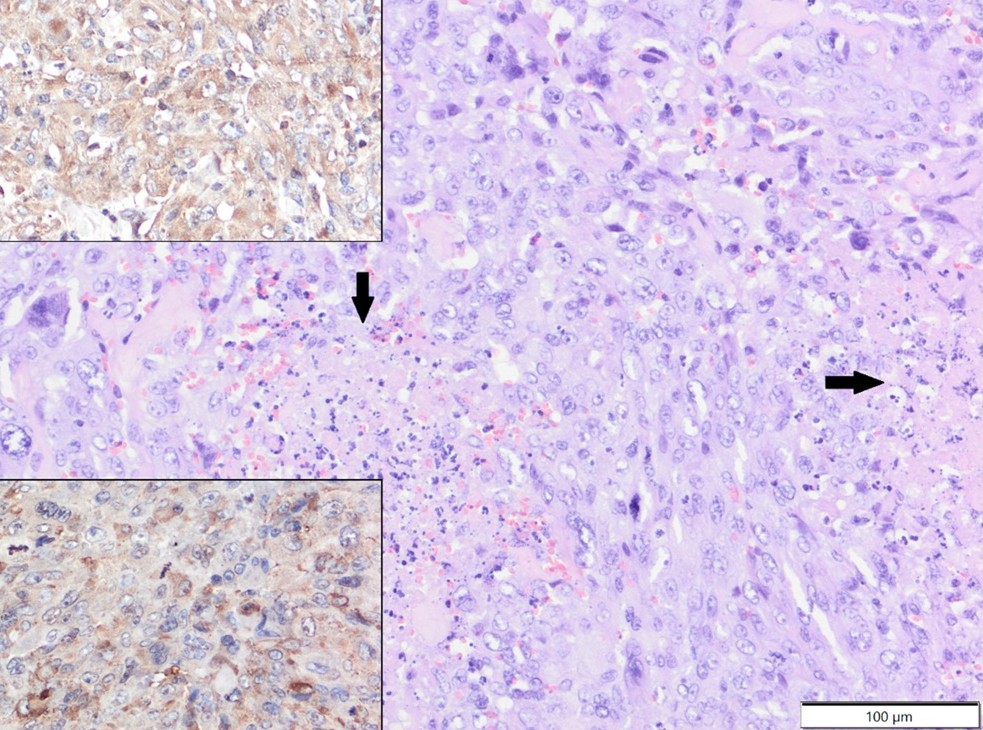
Рисунок 3. Низкодифференцированная саркома, хвост, хорёк. Опухолевые клетки демонстрируют выраженный анизоцитоз и анизокариоз и подвергаются некрозу (стрелки). HE. Верхняя вставка: опухолевые клетки демонстрируют цитоплазматическую экспрессию виментина. IHC. Нижняя вставка: опухолевые клетки демонстрируют слабую цитоплазматическую экспрессию α-SMA. IHC.
Хомяки
Средний возраст поражённых хомяков составил 14,2 месяца (возрастной диапазон: 7–24 месяца), 10 самцов и семь самок. Все эпителиальные опухоли были придаткового происхождения и включали трихоэпителиому (пять случаев, четыре одиночных, один множественный) и по одному случаю каждого из следующих: трихофолликулому, сальную эпителиому, апокриновую аденокарциному и апокриновую протоковую карциному.
Трихоэпителиома была диагностирована у двух золотистых хомяков, одного джунгарского хомяка и одного предкавказского хомяка, и в одном случае вид не был указан. Другие придаточные опухоли были диагностированы у джунгарских хомяков.
Мезенхимальные опухоли (шесть случаев) включали три случая фибросаркомы (диагностирована у одного золотистого хомяка, одного джунгарского хомяка и одного неуточненного вида). Один случай слабодифференцированной саркомы (опухолевые клетки экспрессировали виментин, клон V9 и α-SMA и были отрицательными по десмину и Iba-1), диагностированной у джунгарского хомяка. Один случай простой липомы, диагностированной у золотистого хомяка. И один случай эпителиотропной Т-клеточной лимфомы (опухолевые клетки экспрессировали CD3+ и были отрицательными по CD79a и CD20; Рисунок 4), диагностированной у золотистого хомяка. Также было два случая меланомы (оба у золотистых хомяков).
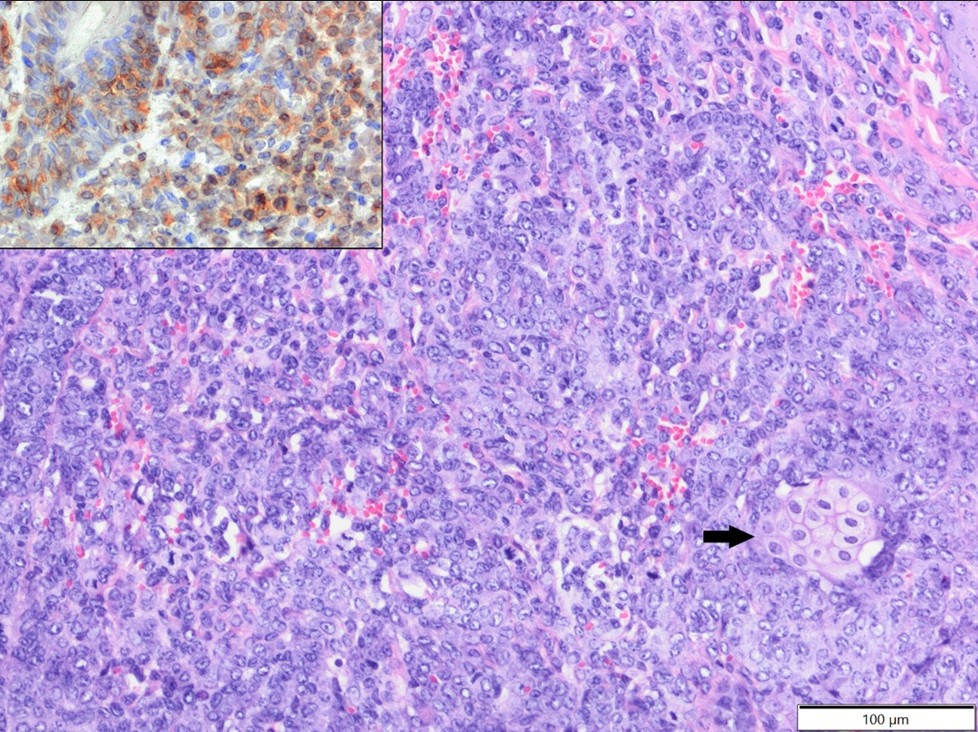
Рисунок 4. Т-клеточная эпителиотропная лимфома, хвост, золотистый хомяк. Крупные лимфоциты массивно инфильтрировали кожу и придатки, видна одна сальная железа (стрелка). HE. Вставка: опухолевые клетки демонстрируют экспрессию CD3. IHC.
Другие виды
У дегу (средний возраст: 4,2 года, возрастной диапазон: 1,5–6 лет; самок: четыре; самцов: три; пол не указан: один), за исключением одного случая эпителиотропной Т-клеточной лимфомы (CD3+), все опухоли были саркомами мягких тканей: фибросаркома – два случая; низкодифференцированная саркома (виментин, клон V9+, Iba-1-, десмин-, α-SMA-) – два случая; миксосаркома – один случай; анапластическая саркома с гигантскими клетками (виментин, клон V9+, Iba-1-, десмин-, α-SMA-; рисунок 5) – один случай. И злокачественная опухоль оболочек периферических нервов – один случай.
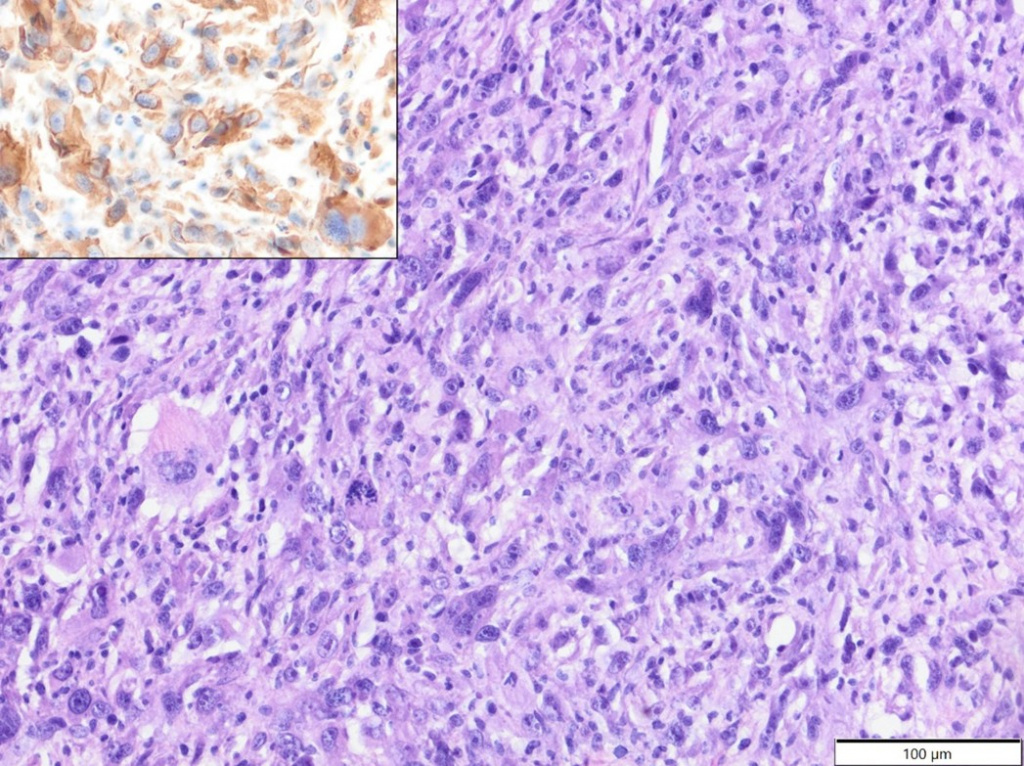
Рисунок 5. Анапластическая саркома с гигантскими клетками, шея, дегу. Опухолевые клетки демонстрируют высокий уровень анаплазии и многоядерности. HE. Вставка: опухолевые клетки демонстрируют цитоплазматическую экспрессию виментина. IHC
У африканских карликовых ежей (средний возраст 4,4 года, возрастной диапазон: 2–7 лет; три самца, две самки) все кожные опухоли были представлены саркомами мягких тканей: фибросаркомой, липосаркомой, злокачественной опухолью оболочек периферических нервов, гистиоцитарной саркомой (опухолевые клетки экспрессировали Iba-1+ и виментин, клон 3B4, и были отрицательными на десмин и α-SMA-; Рисунок 6) и низкодифференцированной саркомой (виментин клон 3B4+, Iba-1-, десмин-, α-SMA-).
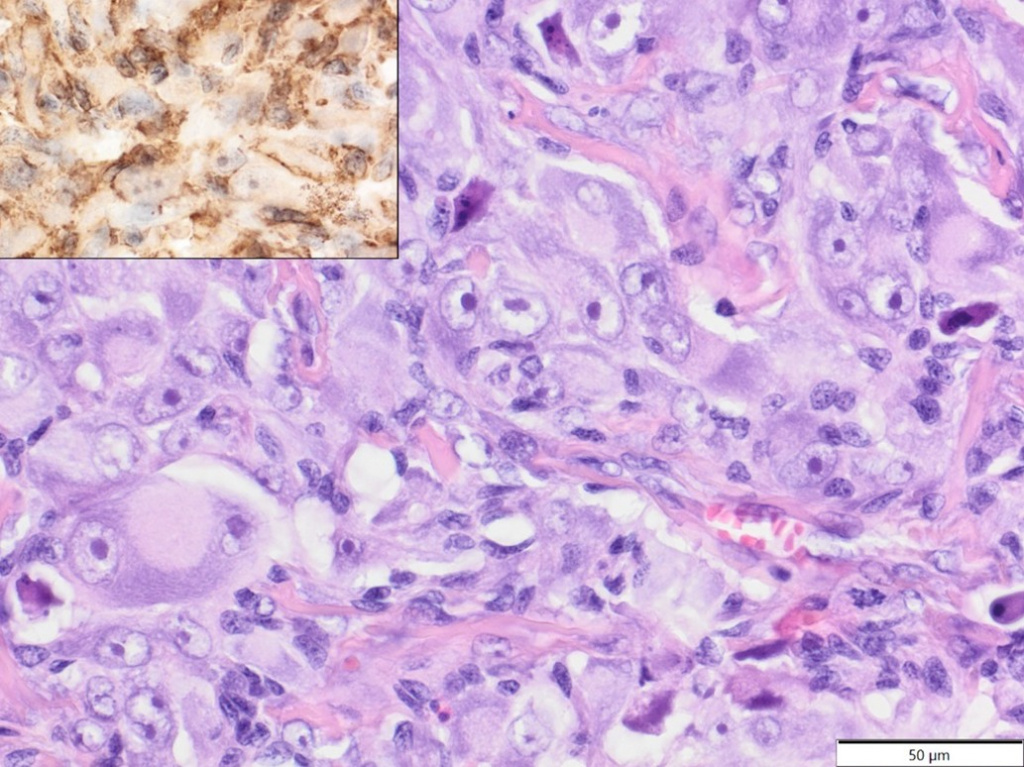
Рисунок 6. Гистиоцитарная саркома, передняя конечность, африканский карликовый ёж. Плеоморфные опухолевые клетки демонстрируют выраженный анизоцитоз и анизокариоз. Ядра крупные с маргинализированным хроматином и чёткими, одиночными ядрышками. HE. Вставка: опухолевые клетки демонстрируют экспрессию Iba-1. IHC.
У монгольских песчанок было два случая эпителиомы пахучих желез брюшной полости (оба двухлетние самцы) и один случай гистиоцитарной саркомы, расположенной в носовой области (возраст неизвестен, самка; опухолевые клетки экспрессировали Iba-1 и виментин, клон V9, и были отрицательными на десмин и α-SMA-). У шиншилл было два случая фибросаркомы (14-летняя самка и 17-летний самец, рисунок 7) и один случай эпителиоидной гемангиомы (возраст неизвестен, самец, рисунок 8).
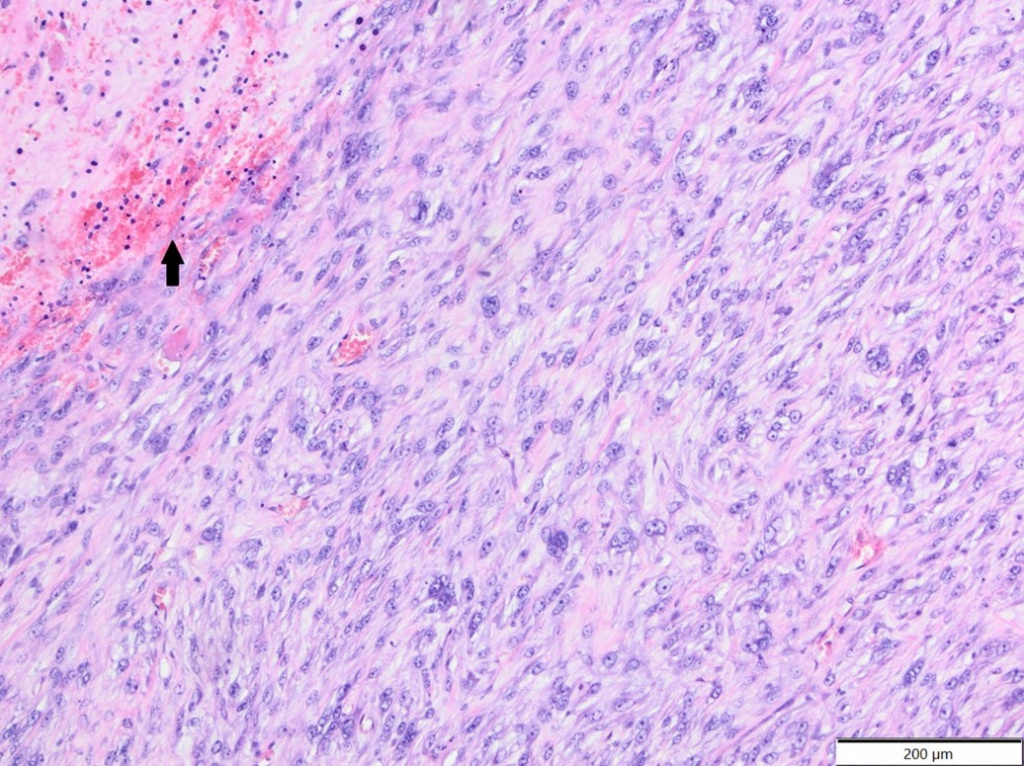
Рисунок 7. Фибросаркома, область не указана, шиншилла. Имеются пучки веретенообразных и овальных опухолевых клеток и умеренное количество коллагеновых волокон между ними. Опухолевые клетки подвергаются фокальному некрозу (стрелка). HE.
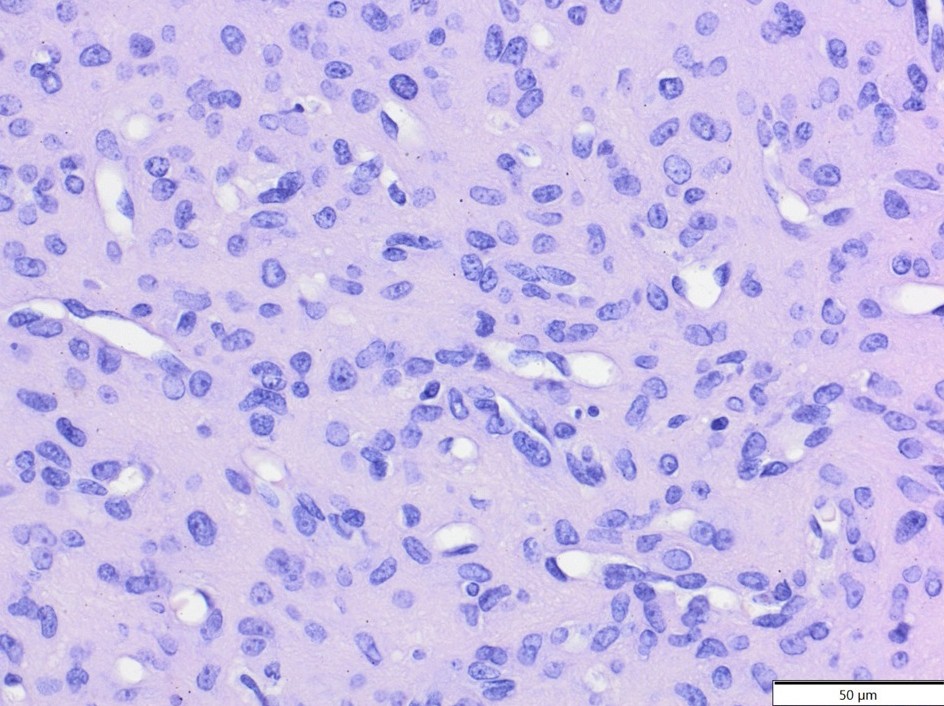
Рисунок 8. Эпителиоидная гемангиома, лицевая (носовая) область, шиншилла. Крупные и пухлые опухолевые клетки образуют мелкие кровеносные сосуды и плотные агрегаты. HE.
Обсуждение
В настоящем исследовании, включающем многочисленные виды мелких млекопитающих, морские свинки были представлены в чрезмерной степени, что отражает популярность этих животных в качестве домашних животных [10].
Кожные опухоли диагностировались в основном у морских свинок среднего возраста (3–4 года), и средний возраст был схожим для разных типов опухолей, за исключением липом, которые, по-видимому, были у немного более молодых животных (средний возраст: 2,9 года), что аналогично предыдущему исследованию [11]. Напротив, Минарикова сообщила, что кожные опухоли значительно чаще диагностировались у морских свинок моложе 2 лет [7]. Подавляющее большинство кожных опухолей, наблюдаемых у морских свинок, были доброкачественными, что соответствует предыдущим отчётам [7,11].
Ранее было показано, что наиболее распространённой кожной опухолью у морских свинок являлась трихофолликулома – доброкачественное новообразование, характеризующееся рудиментарными фолликулярными придаточными структурами в стенках кист, выстланных плоским эпителием [2,11,12], которое иногда ошибочно диагностировали как трихоэпителиому [2,13]. Однако в нашем исследовании наиболее часто диагностируемой доброкачественной опухолью оказалась липома.
Согласно предыдущим сообщениям, липома часто наблюдается у морских свинок и встречается в виде одиночной массы или множественных опухолей [11,13], что также описано в настоящем исследовании. Кроме того, мы наблюдали предрасположенность к паховой области, что также отметили Канфер и Реавил [11].
В настоящем исследовании трихофолликулома была второй по распространённости кожной опухолью у морских свинок и диагностировалась гораздо чаще у самок, тогда как предыдущие исследования предполагали предрасположенность у самцов [13,14]. Хотя большинство кожных опухолей у морских свинок были доброкачественными, мы впервые показали, что значительный процент составляли злокачественные опухоли, представленные в основном саркомами мягких тканей (24%), с преобладанием фибросаркомы, за которой следовала липосаркома.
В предыдущих исследованиях саркомы мягких тканей были зарегистрированы лишь спорадически у морских свинок [7,11,13]. Однако Хокинс и Бишоп отметили, что липосаркома имела относительно высокую распространённость у этого вида [14]. В то время как фибросаркома довольно распространена у домашних животных [15], липосаркома встречается редко [15,16].
Большинство сообщений о спонтанных опухолях у крыс связаны с лабораторными животными [12]. Хотя общая заболеваемость опухолями у крыс высока, кожные и подкожные опухоли встречаются относительно редко [2]. Однако среди всех дерматологических состояний у домашних крыс кожные опухоли чаще всего диагностировались в одной из ветеринарных учебных больниц [17].
В настоящем исследовании домашние крысы составили вторую по численности группу мелких млекопитающих домашних животных, у которых диагностированы опухоли кожи, что позволяет предположить, что эти опухоли не являются редкостью. Кожные и подкожные опухоли диагностировались в основном у крыс среднего и старшего возраста, средний возраст которых составил 21,9 месяца. Ранее было показано, что заболеваемость опухолями особенно высока у крыс старше двух лет [18]. Интересно, что мы наблюдали сильную распространённость среди самцов (73%), что никогда ранее не демонстрировалось.
В отличие от морских свинок, большинство диагностированных кожных и подкожных опухолей у крыс были злокачественными. Мы показали, что наиболее распространёнными опухолями были саркомы мягких тканей с преобладанием фибросаркомы. Результаты предыдущих исследований были противоречивыми. В одном исследовании подкожные мезенхимальные опухоли у крыс встречались чаще, чем эпителиальные опухоли [2], в то время как в другом исследовании наиболее распространённой была плоскоклеточная карцинома [17]. Ранее также было показано, что фибросаркома распространена у крыс среднего и старшего возраста [13], и мы получили схожие результаты.
В нашем исследовании все случаи плохо дифференцированных сарком у крыс прошли базовое иммунофенотипирование. В двух из них опухолевые клетки экспрессировали гистиоцитарный маркер Iba-1 и были классифицированы как гистиоцитарные саркомы. Гистиоцитарная саркома встречается довольно часто у различных линий лабораторных крыс, а подкожная клетчатка является излюбленным местом у крыс Вистар [19,20]. Частота возникновения гистиоцитарной саркомы у крыс-компаньонов неизвестна. Мы показали, что Iba-1 может быть полезным маркером гистиоцитарной саркомы у крыс и может применяться в рутинной диагностике слабодифференцированных сарком для более точной классификации этих опухолей. Ранее иммуногистохимические маркеры, используемые для гистиоцитарных сарком у крыс, включали виментин, CD68 и лизоцим [21]. Однако ранее Iba-1 использовался в качестве маркера макрофагального/микроглиального происхождения опухолей мозга у крыс [22].
В трёх случаях слабодифференцированных сарком опухолевые клетки экспрессировали только виментин и были классифицированы как плеоморфные фибросаркомы. Плеоморфная фибросаркома, ранее известная как злокачественная фиброзная гистиоцитома, считается группой недифференцированных примитивных сарком, диагностируемых у лабораторных животных и людей. У людей эти опухоли далее подразделяются на подкатегории в соответствии с иммунофенотипом и ультраструктурой [9]. Мы показали, что плеоморфные фибросаркомы составляют значительный процент (10,7%) сарком мягких тканей у домашних крыс.
В этом исследовании кожные опухоли наблюдались в основном у домашних кроликов среднего и старшего возраста, и большинство этих опухолей были доброкачественными, наиболее частой из которых была трихобластома (трабекулярного типа), что согласуется с предыдущими исследованиями [3,11,23,24]. Кроме того, большинство кожных опухолей были диагностированы у самцов.
Согласно предыдущим исследованиям, предрасположенность самцов наблюдалась в основном или исключительно в мезенхимальных опухолях [23,24] и может быть результатом общей большей продолжительности жизни самцов кроликов [24]. Некоторые мезенхимальные новообразования, такие как фибромы (также известные как коллагеновые гамартомы), встречаются исключительно у самцов, поэтому предполагается гормональный патогенез [11,23,24].
В текущем исследовании злокачественные опухоли также составили значительный процент всех кожных опухолей (32,6%) и включали саркомы мягких тканей, меланомы и злокачественные опухоли, происходящие из эпидермиса или придатков. Ранее было показано, что большинство кожных мезенхимальных новообразований у кроликов были злокачественными [24], но мы отметили, что процент доброкачественных и злокачественных мезенхимальных опухолей был одинаковым. Меланомы ранее были описаны у домашних кроликов [23]. Хотя большинство ранее зарегистрированных меланом были диагностированы у самцов [11,24], оба случая меланом, включённых в текущее исследование, были подтверждены у самок. Кроме того, мы обнаружили один случай меланоцитомы, который ранее не регистрировался у домашних кроликов.
Опухоли кожи и подкожной клетчатки являются третьими по частоте новообразованиями у хорьков и уступают им по частоте опухолям островковых клеток (инсулинома) и адренокортикальным новообразованиям [5]. В нашем исследовании, как и в недавних исследованиях [5,11,25], опухоли тучных клеток представляли собой наиболее распространённые новообразования кожи, диагностируемые у хорьков.
Кожная мастоцитома у хорьков, в отличие от собак, является универсально доброкачественным новообразованием с хорошим прогнозом, которое не распространяется локально и не метастазирует. Поэтому хирургическое иссечение с хорошими краями является излечивающим [5,11]. Мы наблюдали в основном изолированные формы этого новообразования, но опухоли тучных клеток у хорьков также могут иметь характеристики множественных одновременных поражений [26]. Опухоли тучных клеток чаще встречались у самцов, что согласуется с другими результатами [11].
Однако в нашем исследовании средний возраст поражённых животных составил 3 года, в то время как другие исследователи указали средний возраст от 4,5 до 5 лет для этого типа опухоли [11,26]. Поскольку возрастной диапазон опухолей тучных клеток у хорьков довольно широк и составляет от двух до девяти лет, кажется, что низкий средний возраст случаев новообразований тучных клеток в нашем исследовании мог быть результатом небольшого количества диагностированных случаев. Однако нельзя исключать, что это явление вызвано проблемами содержания, неблагоприятными факторами окружающей среды или генетической предрасположенностью.
Эпителиома сальных желез и плоскоклеточный карцинома заняли второе место по частоте среди диагностированных кожных новообразований у хорьков в нашем исследовании. Эпителиомы сальных желез происходят из плюрипотентных базальных клеток сальных желез, являются доброкачественными, медленно растущими образованиями, не дают метастазов, но могут проявлять локально агрессивный потенциал. Их полное хирургическое удаление обычно приводит к излечению. [5,11].
В нашем исследовании мы не обнаружили половой предрасположенности к этому новообразованию, что согласуется с результатами других исследований [11]. Однако, Паркер и Пикет [27] наблюдали сальную эпителиому чаще у самок. Ранее было показано, что эта опухоль возникала у хорьков в среднем возрасте 5,2 года [11]. Однако, мы диагностировали сальную эпителиому у немного более старых особей, средний возраст которых составлял 6,8 лет. В очень редких случаях сальная эпителиома может привести к плоскоклеточной карциноме [5,25]. Хотя мы диагностировали четыре случая плоскоклеточной карциномы, мы не нашли никаких доказательств её происхождения или связи с сальными железами.
Все наши случаи плоскоклеточной карциномы были диагностированы у самцов среднего возраста (средний возраст 3,8 года), что может указывать на сильную половую предрасположенность. Однако, другие исследования не подтвердили эту корреляцию [11]. Напротив, были единичные сообщения о многоцентровой плоскоклеточной карциноме у самцов [28,29]. В одном из них была подтверждена связь между опухолью и заражением вирусом папилломы [29].
В нашем исследовании эозинофильные внутриядерные включения не были обнаружены в неопластических кератиноцитах, и дополнительные тесты не проводились. Возрастной диапазон плоскоклеточной карциномы у хорьков довольно широк, от 3 до 6 лет (средний возраст 4,5) [11], что близко к результатам нашего исследования. Мы также диагностировали два случая плохо дифференцированной саркомы, экспрессирующей виментин и α-SMA. Хотя ни одна из этих опухолей не была расположена в месте плановой вакцинации (пах и хвост), их иммунофенотип, в соответствии с результатами других исследований [30], мог указывать на то, что они были связаны с инъекцией. Однако у нас не было истории вакцинации этих хорьков.
Новообразования кожи составляют большинство спонтанных опухолей у джунгарских хомяков, в то время как частота этих опухолей у золотистых хомяков низкая [31]. Однако в текущем исследовании эти виды были представлены в равной степени. Большинство поверхностных опухолей у хомяков имеют эпителиальное происхождение [32]. Мы наблюдали, что наиболее распространённой кожной опухолью была трихоэпителиома, за которой следовали фибросаркома и меланома. За исключением трихоэпителиомы, все опухоли придатков были диагностированы у джунгарских хомяков. Ранее было показано, что трихоэпителиомы могут развиваться у золотистых хомяков из-за инфекции полиомавируса хомяка [33].
В нашем исследовании саркомы составляли значительный процент поверхностных опухолей у хомяков и включали фибросаркому и плохо дифференцированную саркому. В слабодифференцированной саркоме опухолевые клетки экспрессировали виментин и α-SMA, что предполагает возможную миофибробластическую дифференцировку. Интересно, что мы не наблюдали атипичную фиброму, происходящую из клеток, подобных ганглиозным клеткам, которая обычно диагностируется у джунгарских хомяков, или её злокачественный аналог [31,34].
Кожные меланомы ранее были зарегистрированы у золотистых хомяков, но с сильной предрасположенностью у самцов [12]. Однако в настоящем исследовании оба случая меланомы наблюдались у самок, хотя общее количество золотистых хомяков в текущем исследовании слишком мало, чтобы делать какие-либо выводы о половой предрасположенности. Мы также наблюдали один случай эпителиотропной Т-клеточной лимфомы, которая ранее была зарегистрирована у золотистых хомяков [35].
Частота неоплазий у дегу низкая, и опухоли спорадически наблюдаются у старых животных [36]. В настоящем исследовании почти все кожные опухоли, наблюдаемые у дегу, были саркомами мягких тканей, а возрастной диапазон составлял 1,5–6 лет, что позволяет предположить, что эти опухоли встречаются не только у старых животных. Ранее сообщалось, что наиболее распространённой опухолью у дегу была кожная фибросаркома [37]. Мы также наблюдали один случай эпителиотропной Т-клеточной лимфомы, которая ранее не была зарегистрирована у дегу.
Ранее было показано, что большинство опухолей у африканских карликовых ежей являлись злокачественными, причём покровные ткани служили их частой локализацией [4,8,38]. В настоящем исследовании все опухоли, диагностированные у африканских карликовых ежей, были злокачественными и представляли собой различные типы сарком мягких тканей. В предыдущем исследовании сообщалось, что большинство кожных опухолей у ежей были мезенхимального происхождения, причём наиболее распространённой была фибросаркома [8]. Интересно, что мы сообщили об одном случае гистиоцитарной саркомы, подтверждённом иммуноэкспрессией Iba-1. Гистиоцитарная саркома ранее была описана у африканских карликовых ежей и встречается в локализованной (кожной) и диссеминированной (висцеральной) формах [39].
Хотя частота спонтанных опухолей у монгольских песчанок довольно высока [40], количество кожных и подкожных опухолей, включённых в настоящее исследование, было низким (три случая). Эти грызуны могут быть не такими популярными в качестве домашних животных, как другие виды мелких млекопитающих, включённые в это исследование, или, по-видимому, не все вырезанные кожные опухоли отправляются на гистопатологию. Мы сообщили о двух случаях эпителиомы пахучих желез брюшной полости, диагностированных у двухлетних самцов. Эпителиомы пахучих желез ранее диагностировались у самцов в аналогичном возрасте [41]. Мы также сообщили об одном случае гистиоцитарной саркомы, и гистиоцитарное происхождение опухолевых клеток было подтверждено иммуноэкспрессией Iba-1. Диссеминированная гистиоцитарная саркома, затрагивающая внутренние органы и костный мозг, ранее была диагностирована у 59-месячной самки монгольской песчанки. Однако фенотип неопластических клеток не был подтверждён иммуногистохимией [42]. Насколько нам известно, наш случай является первым случаем кожной гистиоцитарной саркомы, подтверждённым иммуногистохимическим методом у монгольской песчанки.
В литературе мало информации о кожных и подкожных опухолях у шиншилл [2,13]. Мы диагностировали два случая фибросаркомы у самки и самца, оба пожилого возраста, и одну эпителиоидную гемангиому у самца. Ни один из типов новообразований ранее не был описан в коже и подкожной клетчатке шиншилл.
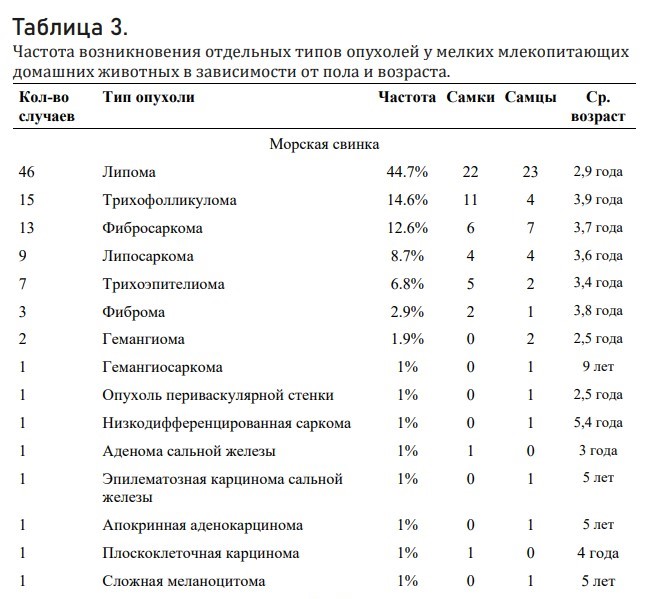
Таблица 3 (полную таблицу со всеми видами смотрите по ссылке). Частота возникновения отдельных типов опухолей у мелких млекопитающих домашних животных в зависимости от пола и возраста.
Выводы
В заключение следует отметить, что кожные и подкожные опухоли представляют собой обширную и гетерогенную группу новообразований у мелких домашних животных, причём значительный процент среди всех образцов кожных опухолей, направленных на гистопатологическое исследование в Польше, составляют злокачественные образования.
Частота встречаемости сарком мягких тканей высока у морских свинок и крыс. Эти опухоли преобладают у дегу, африканских карликовых ежей и шиншилл. Высокий уровень злокачественных новообразований, наблюдаемый в данном исследовании, может быть следствием загрязнения окружающей среды и кормов или других факторов содержания и поведения животных.
Однако следует учитывать, что в этом ретроспективном исследовании анализировались только образцы, направленные на гистопатологию, и вероятно, что злокачественные опухоли чаще подвергались биопсии, чем явно доброкачественные новообразования.
Кроме того, мы наблюдали первый случай меланоцитомы у домашнего кролика, эпителиотропную Т-клеточную лимфому у дегу, кожную гистиоцитарную саркому у монгольской песчанки, фибросаркому у двух шиншилл и эпителиоидную гемангиому у шиншиллы.
Результаты нашего исследования показывают, что Iba-1 может быть полезным маркером гистиоцитарной саркомы у мелких домашних млекопитающих и должен применяться в рутинной диагностике плохо дифференцированных сарком. Важно отслеживать неопластические заболевания у мелких домашних млекопитающих для улучшения диагностики и лечения.
➡️ С оригиналом статьи можно ознакомиться по ссылке
Список литературы
1. O’Brien D.J., Kaneene J.B., Poppenga R.H. The use of mammals as sentinels for human exposure to toxic contaminants in the environment. Environ. Health Perspect. 1993;99:351–368. doi: 10.1289/ehp.9399351.
2. Greenacre C.B. Spontaneous tumors of small mammals. Vet. Clin. N. Am. Exot. Anim. Pract. 2004;7:627–651. doi: 10.1016/j.cvex.2004.04.009.
3. Bertram C.A., Bertram B., Bartel A., Ewringmann A., Fragoso-Garcia M.A., Erickson N.A., Müller K., Klopfleisch R. Neoplasia and Tumor-Like Lesions in Pet Rabbits (Oryctolagus cuniculus): A Retrospective Analysis of Cases Between 1995 and 2019. Vet. Pathol. 2021;58:901–911. doi: 10.1177/0300985820973460.
4. Raymond J.T., Garner M.M. Spontaneous tumours in captive African hedgehogs (Atelerix albiventris): A retrospective study. J. Comp. Pathol. 2001;124:128–133. doi: 10.1053/jcpa.2000.0441.
5. Williams B.H., Wyre N.R. Neoplasia in Ferrets. In: Quesenberry K.E., Orcutt C.J., Mans C., Carpenter J.W., editors. Ferrets, Rabbits, and Rodents. 4th ed. Elsevier Ltd.; Oxford, UK: 2020. pp. 92–108.
6. Mauldin E.A., Goldschmidt M.H. A retrospective study of cutaneous neoplasms in domestic rabbits (1990–2001) Vet. Dermatol. 2002;13:214. doi: 10.1046/j.1365-3164.2002.00298_6.x.
7. Minarikova A., Hauptman K., Jeklova E., Knotek Z., Jekl V. Diseases in pet guinea pigs: A retrospective study in 1000 animals. Vet. Rec. 2015;177:200. doi: 10.1136/vr.103053.
8. Okada K., Kondo H., Sumi A., Kagawa Y. A retrospective study of disease incidence in African pygmy hedgehogs (Atelerix albiventris) J. Vet. Med. Sci. 2018;80:1504–1510. doi: 10.1292/jvms.18-0238.
9. Greaves P., Chouinard L., Ernst H., Mecklenburg L., Pruimboom-Brees I.M., Rinke M., Rittinghausen S., Thibault S., Von Erichsen J., Yoshida T. Proliferative and non-proliferative lesions of the rat and mouse soft tissue, skeletal muscle and mesothelium. J. Toxicol. Pathol. 2013;26:1S–26S. doi: 10.1293/tox.26.1S.
10. Quesenberry K.E. Guinea pigs. Vet. Clin. N. Am. Small Anim. Pract. 1994;24:67–87. doi: 10.1016/S0195-5616(94)50003-2.
11. Kanfer S., Reavill D.R. Cutaneous neoplasia in ferrets, rabbits, and guinea pigs. Vet. Clin. N. Am. Exot. Anim. Pract. 2013;16:579–598. doi: 10.1016/j.cvex.2013.05.006.
12. Hocker S.E., Eshar D., Wouda R.M. Rodent Oncology: Diseases, Diagnostics, and Therapeutics. Vet. Clin. N. Am. Exot. Anim. Pract. 2017;20:111–134. doi: 10.1016/j.cvex.2016.07.006.
13. Garner M.M. Cytologic diagnosis of diseases of rabbits, guinea pigs, and rodents. Vet. Clin. N. Am. Exot. Anim. Pract. 2007;10:25–49. doi: 10.1016/j.cvex.2006.10.002.
14. Hawkins M.G., Bishop C.R. Disease Problems of Guinea Pigs. In: Quesenberry K.E., Carpenter J.W., editors. Ferrets, Rabbits, and Rodents: Clinical Medicine and Surgery. 3rd ed. Elsevier Saunders; St. Louis, MO, USA: 2012. pp. 295–310.
15. Meuten D.J., editor. Tumors in Domestic Animals. 5th ed. Wiley Blackwell; Ames, IA, USA: 2017. pp. 144–145, 159–162.
16. Doria-Torra G., Martínez J., Domingo M., Vidaña B., Isidoro-Ayza M., Casanova M.I., Vidal E. Liposarcoma in animals: Literature review and case report in a domestic pig (Sus scrofa) J. Vet. Diagn. Investig. 2015;27:196–202. doi: 10.1177/1040638714567190.
17. White S.D., Bourdeau P.J., Brément T., Bruet V., Gimenez-Acosta C., Guzman D.S., Paul-Murphy J., Hawkins M.G. Companion rats (Rattus norvegicus) with cutaneous lesions: A retrospective study of 470 cases at two university veterinary teaching hospitals (1985–2018) Vet. Dermatol. 2019;30:237-e72. doi: 10.1111/vde.12735.
18. Ellis C., Mori M. Skin diseases of rodents and small exotic mammals. Vet. Clin. N. Am. Exot. Anim. Pract. 2001;4:493–542. doi: 10.1016/S1094-9194(17)30041-5.
19. Barsoum N.J., Hanna W., Gough A.W., Smith G.S., Sturgess J.M., de la Iglesia F.A. Histiocytic sarcoma in Wistar rats. A light microscopic, immunohistochemical, and ultrastructural study. Arch. Pathol. Lab. Med. 1984;108:802–807.
20. Frith C.H., Ward J.M., Chandra M. The morphology, immunohistochemistry, and incidence of hematopoietic neoplasms in mice and rats. Toxicol. Pathol. 1993;21:206–218. doi: 10.1177/019262339302100213.
21. Kemmochi Y., Takahashi A., Miyajima K., Yasui Y., Tanoue G., Shoda T., Kakimoto K. Spontaneous histiocytic sarcoma of the popliteal lymph node in a young sprague-dawley rat. J. Toxicol. Pathol. 2010;23:161–164. doi: 10.1293/tox.23.161.
22. Kolenda-Roberts H.M., Harris N., Singletary E., Hardisty J.F. Immunohistochemical characterization of spontaneous and acrylonitrile-induced brain tumors in the rat. Toxicol. Pathol. 2013;41:98–108. doi: 10.1177/0192623312452492.
23. Von Bomhard W., Goldschmidt M.H., Shofer F.S., Perl L., Rosenthal K.L., Mauldin E.A. Cutaneous neoplasms in pet rabbits: A retrospective study. Vet. Pathol. 2007;44:579–588. doi: 10.1354/vp.44-5-579.
24. Baum B. Not Just Uterine Adenocarcinoma-Neoplastic and Non-Neoplastic Masses in Domestic Pet Rabbits (Oryctolagus cuniculus): A Review. Vet. Pathol. 2021;58:890–900. doi: 10.1177/03009858211002190.
25. Avallone G., Forlani A., Tecilla M., Riccardi E., Belluco S., Santagostino S.F., Grilli G., Khadivi K., Roccabianca P. Neoplastic diseases in the domestic ferret (Mustela putorius furo) in Italy: Classification and tissue distribution of 856 cases (2000–2010) BMC Vet. Res. 2016;12:275. doi: 10.1186/s12917-016-0901-7.
26. Vilalta L., Meléndez-Lazo A., Doria G., Ramis A., Solano-Gallego L., Pastor J., Martorell J. Clinical, Cytological, Histological and Immunohistochemical Features of Cutaneous Mast Cell Tumours in Ferrets (Mustela putorius furo) J. Comp. Pathol. 2016;155:346–355. doi: 10.1016/j.jcpa.2016.07.012.
27. Parker G.A., Picut C.A. Histopathologic features and post-surgical sequelae of 57 cutaneous neoplasms in ferrets (Mustela putorius furo L.) Vet. Pathol. 1993;30:499–504. doi: 10.1177/030098589303000602.
28. Olsen G.H., Turk M.A., Foil C.S. Disseminated cutaneous squamous cell carcinoma in a ferret. J. Am. Vet. Med. Assoc. 1985;186:702–703.
29. Rodrigues A., Gates L., Payne H.R., Kiupel M., Mansell J. Multicentric squamous cell carcinoma in situ associated with papillomavirus in a ferret. Vet. Pathol. 2010;47:964–968. doi: 10.1177/0300985810369899.
30. Munday J.S., Stedman N.L., Richey L.J. Histology and immunohistochemistry of seven ferret vaccination-site fibrosarcomas. Vet. Pathol. 2003;40:288–293. doi: 10.1354/vp.40-3-288.
31. Kondo H., Onuma M., Shibuya H., Sato T. Spontaneous tumors in domestic hamsters. Vet. Pathol. 2008;45:674–680. doi: 10.1354/vp.45-5-674.
32. Rother N., Bertram C.A., Klopfleisch R., Fragoso-Garcia M., Bomhard W.V., Schandelmaier C., Müller K. Tumours in 177 pet hamsters. Vet. Rec. 2021;188:e14. doi: 10.1002/vetr.14.
33. Foster A.P., Brown P.J., Jandrig B., Grosch A., Voronkova T., Scherneck S., Ulrich R. Polyomavirus infection in hamsters and trichoepitheliomas/cutaneous adnexal tumours. Vet. Rec. 2002;151:13–17. doi: 10.1136/vr.151.1.13.
34. Baba Y., Takahashi K., Nakamura S. Androgen-dependent atypical fibromas spontaneously arising in the skin of Djungarian hamsters (Phodopus sungorus) Comp. Med. 2003;53:527–531.
35. Harvey R.G., Whitbread T.J., Ferrer L., Cooper J.E. Epidermotropic Cutaneous T-Cell Lymphoma (mycosis fungoides) in Syrian Hamsters (Mesocricetus auratus). A Report of Six Cases and the Demonstration of T-Cell Specificity. Vet. Dermatol. 1992;3:13–19. doi: 10.1111/j.1365-3164.1992.tb00138.x.
36. Colby L.A., Rush H.G., Mahoney M.M., Lee T.M. Degu. In: Suckow M.A., Stevens K.A., Wilson R.P., editors. The Laboratory Rabbit, Guinea Pig, Hamster, and Other Rodents. Academic Press; Cambridge, MA, USA: 2012. pp. 1031–1053.
37. Švara T., Gombač M., Poli A., Račnik J., Zadravec M. Spontaneous Tumors and Non-Neoplastic Proliferative Lesions in Pet Degus (Octodon degus) Vet. Sci. 2020;7:32. doi: 10.3390/vetsci7010032.
38. Heatley J.J., Mauldin G.E., Cho D.Y. A Review of Neoplasia in the Captive African Hedgehog (Atelerix albiventris) Semin. Avian Exot. Pet Med. 2005;14:182–192. doi: 10.1016/j.saep.2005.07.002.
39. Makishima R., Kondo H., Shibuya H. Clinical, histopathological, and immunohistochemical studies of histiocytic sarcoma in four-toed hedgehogs (Atelerix albiventris): A retrospective study. J. Vet. Med. Sci. 2021;83:419–426. doi: 10.1292/jvms.20-0493.
40. Matsuoka K., Suzuki J. Spontaneous tumors in the Mongolian gerbil (Meriones unguiculatus) Exp. Anim. 1995;43:755–760. doi: 10.1538/expanim1978.43.5_755.
41. Deutschland M., Denk D., Skerritt G., Hetzel U. Surgical excision and morphological evaluation of altered abdominal scent glands in Mongolian gerbils (Meriones unguiculatus) Vet. Rec. 2011;169:636. doi: 10.1136/vr.100380.
42. Chen H.C., Slone T.W., Jr., Frith C.H. Histiocytic sarcoma in an aging gerbil. Toxicol. Pathol. 1992;20:260–263. doi: 10.1177/019262339202000213.

