Что даёт цитологическая диагностика: всесторонний эпидемиологический ретроспективный анализ 3068 случаев у кошек
Краткое изложение
Цитология — это малоинвазивный и экономически эффективный диагностический метод, применяемый в ветеринарной медицине для исследования клеток из тканей, жидкостей и других структур организма. В данном исследовании были проанализированы более 3000 случаев у кошек в Португалии с целью оценки эффективности цитологии при диагностике различных патологий. Наибольшая диагностическая результативность отмечена при исследовании жидкостей и тканей желез, тогда как образцы из кожных поражений и лимфатических узлов представляли больше трудностей. Опухоли чаще выявлялись у пожилых кошек, тогда как у молодых животных преобладали воспалительные процессы. Некоторые опухоли, например эпителиальные, чаще встречались у самок, в то время как мезенхимальные новообразования были более распространены у самцов. Образцы низкого качества или неполные пробы нередко приводили к неубедительным результатам, что подчёркивает важность правильного сбора и подготовки материала. Данное исследование демонстрирует ключевую роль цитологии в раннем выявлении заболеваний, выборе тактики лечения и повышении качества ветеринарной помощи кошкам. При тщательном обращении с образцами и интеграции с другими методами диагностики цитология остаётся незаменимым инструментом в ветеринарной практике.
Аннотация
В данном исследовании были оценены диагностические тенденции и общая значимость цитологии у кошек на основе анализа крупного мультицентрового набора данных из Португалии. Проведён ретроспективный обзор 3068 цитологических случаев из 130 ветеринарных клиник; образцы классифицировались по анатомической локализации и типу поражения. Результаты диагностики были подвергнуты статистическому анализу, который показал общую диагностическую эффективность 66,20%. Наибольшая диагностическая информативность отмечена при исследовании жидкостей (83,48%), тканей желез (76,67%) и слизистых оболочек (75,81%), за которыми следовали образцы органов (67,79%), прочих тканей (66,98%), кожных/подкожных узлов (62,16%) и лимфатических узлов (57,93%). Неопластические поражения демонстрировали возрастную зависимость: они чаще встречались у пожилых кошек; при этом эпителиальные и меланоцитарные поражения преобладали у самок, а круглоклеточные опухоли и мезенхимальные — у самцов. Недостаточная диагностичность (33,80%) в основном была связана с низкой клеточностью или неудовлетворительным качеством материала, однако значимой корреляции между успешностью диагностики и клиническим учреждением выявлено не было. Данное исследование подтверждает, что цитология остаётся одним из важнейших диагностических инструментов в медицине кошек, особенно при правильном заборе материала и использовании дополнительных методов диагностики, и подчёркивает её ценность для клинического принятия решений, тем самым поддерживая её более широкое применение в рутинной ветеринарной практике.
1. Введение
Цитология является важным диагностическим инструментом в ветеринарной медицине, широко признанным за простоту выполнения, малоинвазивность и экономическую эффективность [1,2,3,4]. Этот метод обеспечивает быстрый и доступный способ оценки клеточного состава поражений [4,5], что способствует диагностике и классификации широкого спектра патологических состояний. Благодаря своей универсальности цитология рутинно применяется при исследовании кожных и подкожных новообразований, кистозных образований, язвенных поражений и свищевых ходов. Кроме того, она играет ключевую роль в исследовании образцов органов и биологических жидкостей, включая выпоты, спинномозговую жидкость (СМЖ), мочу и синовиальную жидкость [2,3,4,6,7,8,9,10,11].
Для получения цитологических образцов доступен широкий спектр методов, включая тонкоигольную аспирационную биопсию (ТИАБ), тонкоигольную биопсию без аспирации, мазки-отпечатки, мазки с поверхности и соскобы [12,13,14]. Выбор метода во многом зависит от характеристик поражения, его анатомической локализации и предпочтений врача [13]. Несмотря на многочисленные преимущества, цитология имеет присущие ей ограничения [15,16], главным из которых является невозможность оценки тканевой архитектоники, критически важной для различения доброкачественных и злокачественных процессов [17]. Тем не менее цитология зачастую может предоставить достаточный объём информации для постановки окончательного диагноза. В случаях, когда достичь окончательного заключения невозможно, полученные при цитологическом исследовании данные позволяют направить дальнейшую диагностику к получению окончательного результата [7,18,19,20].
Диагностическая точность цитологии зависит от множества факторов, включая качество образца, сохранность клеток и методы приготовления препаратов. Неправильный выбор материала, неадекватные методы забора и некорректная подготовка мазков могут приводить к недиагностичным или сомнительным результатам [2,18,21]. Поэтому внимание к процедурам получения и подготовки образцов является необходимым условием для максимального повышения клинической ценности цитологического исследования. Ряд исследований у мелких домашних животных подтвердил диагностическую значимость цитологии [1,5,6,7,11,15,19,20,22,23,24,25]. В медицине кошек цитология широко используется для диагностики неопластических и воспалительных процессов, поражающих кожные и подкожные образования [7,11,26], внутренние органы, такие как селезёнка [27] и мочевыделительная система/почки [28], кости [25], скелетные мышцы [29], полость рта [1,24], лимфатическую систему [5,15] и молочную железу [30].
В настоящем исследовании проведён комплексный ретроспективный анализ цитологических диагнозов у кошек за семилетний период, включающий 3068 случаев из ветеринарных клиник по всей Португалии. Насколько известно авторам, это первое крупномасштабное исследование эпидемиологической значимости цитологии в диагностике заболеваний кошек в стране. Анализ диагностических тенденций и результатов подчёркивает ключевую роль цитологии в ветеринарной медицине, подтверждая её значение как важного инструмента для раннего выявления заболеваний и обоснованного клинического принятия решений.
2. Материалы и методы
2.1. Сбор данных, отбор проб и диагностические процедуры
Цитологические образцы направлялись в INNO Veterinary Laboratories (Брага, Португалия) в течение семилетнего периода. Материал поступал из 130 ветеринарных клиник, расположенных во всех округах материковой части Португалии, а также из автономных островных регионов.
Подавляющее большинство цитологических образцов поступало без окраски. Они обрабатывались в лаборатории и окрашивались красителем типа Романовского (Hemacolor®, Merck KGaA, Дармштадт, Германия) с использованием автоматического окрашивателя RAL Stainer (RAL Diagnostics, Мартийак, Франция), что обеспечивало стабильное и воспроизводимое качество окраски. Протокол окрашивания соответствовал инструкциям производителя. Уже окрашенные препараты направлялись лишь в редких случаях (<5%), однако из-за ретроспективного характера исследования точная доля и подробности применявшихся внешних методов окраски не могли быть установлены.
После окрашивания все препараты заключались в среду Entellan™ (Sigma-Aldrich, Сент-Луис, США) для сохранения препаратов. Микроскопическая оценка проводилась с использованием микроскопа Nikon Eclipse 600 (Nikon Corporation, Токио, Япония), оснащённого объективами CFI Plan Achromat: 10× (Ref. MRP70100), 20× (Ref. MRL00202), 40× (Ref. MRP70400), 50× (Ref. MRL01502) и 100× с иммерсией в масло (Ref. MRL01903). В данном исследовании не применялись методы цифрового сканирования; все исследования выполнялись методом прямой световой микроскопии. Цитологическую интерпретацию проводили два опытных клинических патолога, каждый из которых имел более 30 лет непрерывной практики в диагностической цитопатологии. Хотя они не являлись дипломированными специалистами соответствующих коллегий, оба эксперта имели обширную подготовку и хорошо зарекомендовали себя в данной области, что обеспечивало высокий уровень диагностической согласованности и надёжности в ходе всего исследования. На протяжении всего семилетнего периода исследования (2011–2016) цитологическую оценку проводили одни и те же два специалиста. Все образцы изначально оценивались независимо; в случаях неопределённости или сомнительных результатов патологи обсуждали данные совместно, чтобы прийти к консенсусному диагнозу. При диагностических затруднениях в процесс пересмотра привлекались и другие соавторы, также имеющие опыт цитологической интерпретации, с целью достижения расширенного консенсуса. Кроме того, в отдельных случаях образцы направлялись во внешние специализированные ветеринарные лаборатории для получения второго экспертного заключения, что дополнительно подтверждало точность и согласованность окончательного диагноза. Жидкостные образцы направлялись либо в обычных пробирках, либо в пробирках с ЭДТА. Они транспортировались в охлаждённом состоянии, при этом стабильность образцов обеспечивалась контролируемым температурным режимом, поддерживаемым специализированной логистической службой лаборатории. В случаях низкой клеточности по прибытии выполнялась центрифугирование для концентрации клеточных элементов перед приготовлением мазков. Из-за ретроспективного характера исследования данные о конкретных методах получения образцов (например, тонкоигольная аспирация, пункция без аспирации, отпечатки) были недоступны. Тем не менее все образцы собирались в соответствии с руководящими принципами и рекомендациями по лучшей практике, предоставленными лабораторией всем участвовавшим клиникам.
К каждому образцу прилагалась лабораторная форма-заявка, содержащая ключевую клиническую информацию, включая породу, пол, возраст, предполагаемый диагноз или клинические признаки, анатомическую локализацию образца и запрошенные исследования. Возраст животных был разделён на семь категорий в соответствии с ранее описанной методикой [31].
Образцы классифицировались по анатомической локализации следующим образом: подкожные и кожные образования; лимфатические узлы; железистые ткани (включая молочные и эндокринные железы, а также поджелудочную железу); жидкости (синовия, моча, трахеальные и бронхоальвеолярные смывы); прочие (внутрибрюшные и внутригрудные образования, средостение, брыжейка, кости, ухо, семенники и половой член); слизистые оболочки (влагалищная, ротовая, глазная, носовая и анальная); органы (лёгкие, почки, печень и селезёнка).
Образцы, для которых требовались дополнительные диагностические методы, такие как миелограммы костного мозга, плевральные, абдоминальные и перикардиальные выпоты или спинномозговая жидкость, из исследования исключались.
Кроме того, образцы классифицировались по диагностическим категориям: неопластические (включающие эпителиальные, веретеноклеточные, круглоклеточные и меланоцитарные поражения) [28,32]; воспалительные (подразделялись на инфекционные, гнойные, пиогранулематозные/гранулематозные, эозинофильные, лимфоцитарные, плазмоцитарные и неопределённого происхождения) [12,28,32,33]; не неопластические/невоспалительные (включающие кистозные, дегенеративные и геморрагические поражения, гиперплазию, кортикостероид-индуцированную гепатопатию, очаги экстрамедуллярного гемопоэза и др.) [34,35]; а также категория «прочие», куда относили нормальные образцы и вагинальную цитологию для определения стадий полового цикла. Термин «инфекционные» использовался в случаях цитологического подтверждения инфекционных агентов независимо от преобладающего типа воспалительных клеток. Недиагностические категории подразделялись на «ориентировочные» (дающие наводящую информацию для постановки вероятного диагноза, например, когда невозможно определить подтип неоплазии) и «неубедительные» (характеризующиеся низкой клеточностью, гемодилюцией, низким качеством образца или разрушенными клетками) [36,37].
Классификация была дополнительно упрощена до двух основных категорий: неопластические и не неопластические, при этом в последнюю входили воспалительные процессы, не неопластические/невоспалительные изменения и другие типы образцов.
Настоящее исследование основано исключительно на цитологических диагнозах. Хотя в отдельных случаях могла проводиться гистопатологическая верификация в рамках рутинного клинического наблюдения, такие данные не собирались и не анализировались систематически, и гистология не использовалась для подтверждения или пересмотра представленных цитологических заключений. Основной задачей настоящего исследования было не сопоставление цитологии с гистопатологией по уровню диагностической точности, а предоставление широкого эпидемиологического обзора применения цитологии и её результатов у кошек.
2.2. Статистический анализ
Статистическая обработка выполнялась с использованием JMP®, версия 14.3 (SAS Institute, Кэри, Северная Каролина, США, 1989–2023), DATAtab® (DATAtab e.U., Грац, Австрия, 2024) и MedCalc® Statistical Software, версия 20.006 (MedCalc Software Ltd., Остенде, Бельгия).
Различия в пропорциях оценивались с помощью критерия χ² (хи-квадрат); при ожидаемой частоте менее пяти применялся точный критерий Фишера.
Для анализа породной предрасположенности использовалась однофакторная логистическая регрессия с целью определения вероятности неопластических по сравнению с не неопластическими состояниями, с учётом возможных смещений в представленности пород.
За уровень статистической значимости принималось значение p ≤ 0,05.
3. Результаты
Всего для анализа было получено 3068 образцов животных.
Из них 1597 образцов (52,05%; 95% ДИ: 50,3–53,8%) были от самок и 1471 (48,0%; 95% ДИ: 46,2–49,7%) — от самцов.
Информация о породе отсутствовала в 590 (19,24%) формах-заявках. Из имеющихся данных (n = 2478) было выявлено 13 различных пород. Распределение по породам выглядело следующим образом: 2018 Домашняя короткошерстная кошка (DSH) (65,80%), 247 Персидская (8,05%), 141 Сиамская (4,60%), 30 Норвежская лесная (0,98%), 10 Сфинкс (0,33%), 9 Мейн-кун (0,29%), 6 Турецкая ангора (0,20%), 6 Бирманская (0,20%), 4 Британская короткошерстная (0,13%), 2 Скоттиш-фолд (0,07%), 2 Сомали (0,07%), 1 Бобтейл (0,03%) и 1 Шартрез (0,03%).
Данные о возрасте были доступны для 2625 животных (85,56%), тогда как 443 формы-заявки (14,44%) не содержали информации о возрасте животных. Возраст животных варьировал от ≤1 года (6 месяцев) до 23 лет, при этом медиана возраста составила 8 лет (межквартильный размах: 4–12 лет). В целом 13,2% (95% ДИ: 12,0–14,6; n = 347) были классифицированы как котята (kittens), 6,2% (95% ДИ: 5,4–7,2; n = 163) как молодые (young), 10,0% (95% ДИ: 8,9–11,2; n = 263) как молодые взрослые (young adults), 16,0% (95% ДИ: 14,6–17,4; n = 419) как взрослые (adults), 19,1% (95% ДИ: 17,7–20,7; n = 502) как зрелые взрослые (mature adults), 30,0% (95% ДИ: 27,8–31,3; n = 775) как пожилые (seniors) и 5,9% (95% ДИ: 5,1–6,9; n = 156) как старые (geriatrics).
3.1 Диагностическая эффективность
В данном исследовании из 3068 проанализированных цитологических образцов 2031 (66,20%) позволили поставить окончательный диагноз, тогда как 1037 (33,80%) оказались недиагностическими. Среди диагностических результатов 714 образцов (23,27% от общего числа) относились к неопластическим, 691 образец (22,52%) показал воспалительные изменения, 439 образцов (14,31%) были классифицированы как не неопластические и невоспалительные, а 187 образцов (6,1%) попали в категорию «прочие». Среди недиагностических образцов 564 (18,38%) давали ориентировочные результаты, указывающие на возможный диагноз, а 473 (15,42%) были неубедительными, не предоставляя ни конкретной, ни наводящей информации.
По анатомической локализации большинство образцов (n = 1094) были получены из кожных и подкожных узловых образований. Из них 62,16% содержали достаточные цитологические признаки для постановки окончательного диагноза. Всего было получено 444 образца из внутренних органов, из которых 67,79% соответствовали критериям для цитологической оценки. Аспираты лимфатических узлов включали 274 образца, из которых 57,93% считались цитологически интерпретируемыми. Образцы железистой ткани были получены в 138 случаях, при этом высокий процент (76,67%) оказался пригодным для интерпретации. Слизистые оболочки дали 257 образцов, из которых 75,81% были признаны адекватными для диагностической оценки. Среди 142 образцов, классифицированных как «прочие», 66,98% были пригодны для интерпретации. Наконец, жидкостные образцы (n = 96) показали наибольшую долю пригодного для интерпретации материала — 83,48%. Распределение пригодности образцов по анатомическим локализациям представлено на рисунке 1.
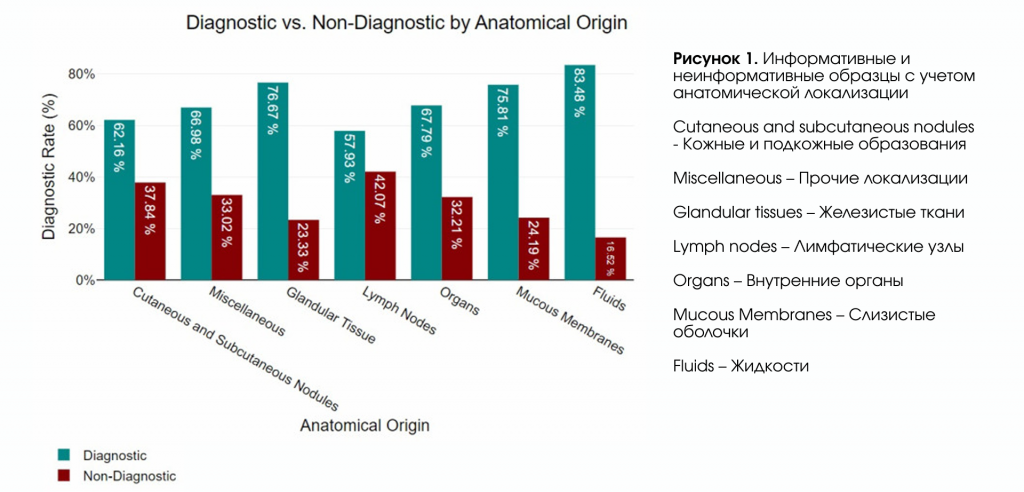
3.2. Неопластические и не неопластические диагнозы
Сначала изучалась частота неопластических процессов с точки зрения эпидемиологических факторов (пол, порода и возраст), а затем проводилась оценка в зависимости от анатомической локализации.
Всего было оценено 2031 образец, из которых 1083 от самок и 948 от самцов. Среди образцов самок 392 (54,90%) были диагностированы как неопластические, тогда как 691 (52,47%) — как не неопластические. В группе самцов 322 образца (45,10%) оказались неопластическими, а 626 (47,53%) — не неопластическими. В целом, неопластические поражения составляли 714 случаев (35,16%) от общего числа образцов, в то время как не неопластические случаи преобладали и насчитывали 1317 случаев (64,84%). Критерий χ² для проверки независимости между полами не выявил значимой связи между неопластическими поражениями у самцов и самок (p = 0,294), что указывает на одинаковую частоту возникновения неопластических процессов среди оценённых полов.
Что касается породы, значимой связи между породой и возникновением неопластических поражений не выявлено (критерий χ², p = 0,303), что указывает на равномерное распределение случаев неопластических процессов среди различных оценённых пород. В отличие от пола и породы, возраст показал значимую связь с частотой возникновения неоплазий (критерий χ², p < 0,001). У животных в возрасте ≤ 1 года 10,3% поражений были неопластическими. Эта доля увеличилась до 21,4% в группе >1 до ≤2 лет и до 24,3% в группе >2 до ≤4 лет. Эти молодые животные служили базовой группой для сравнения, при этом группа ≤1 года была принята за эталон (отношение шансов (OR) = 1).
Вероятность постановки неопластического диагноза прогрессивно увеличивалась с возрастом:
>1 до ≤2 лет: OR = 0,97 (95% ДИ: 0,60–1,55);
>2 до ≤4 лет: OR = 1,14 (95% ДИ: 0,76–1,70);
>4 до ≤7 лет: OR = 1,39 (95% ДИ: 1,00–1,93);
>7 до ≤10 лет: OR = 2,68 (95% ДИ: 1,98–3,62);
>10 до ≤15 лет: OR = 3,73 (95% ДИ: 2,85–4,88);
>15 лет: OR = 4,90 (95% ДИ: 3,14–7,66).
В таблице 1 представлено распределение не неопластических и неопластических поражений в зависимости от возрастной группы.
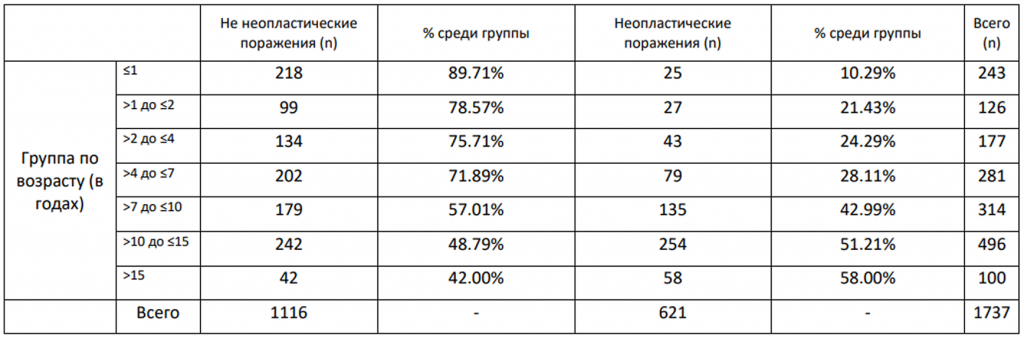
Таблица 1. Распределение не неопластических и неопластических поражений в зависимости от возрастной группы.
3.2.2. Распределение неопластических и не неопластических поражений по анатомической локализации
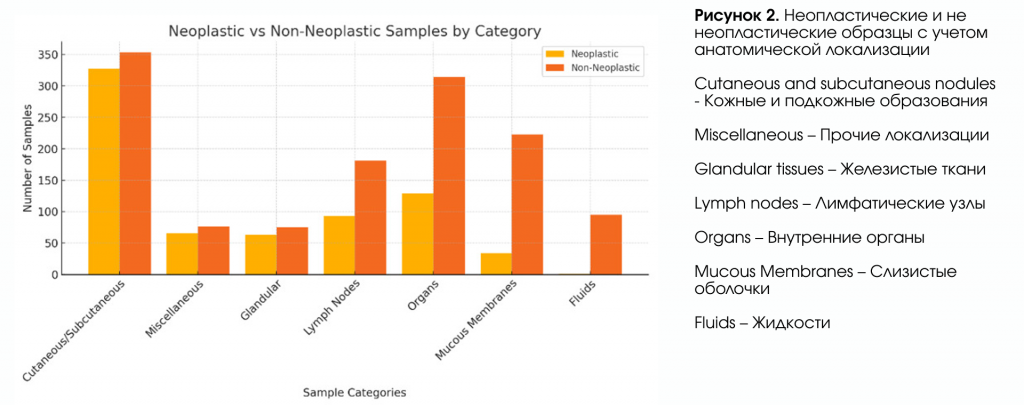
В анализируемой выборке кожные и подкожные новообразования составили основную категорию, включающую 680 образцов, из которых 48,09% (n = 327) были охарактеризованы как неопластические, а 51,91% (n = 353) — как не неопластические. Вторая по величине категория, состоящая из 142 образцов, классифицированных как «прочие», показала частоту неопластических поражений 46,48% (n = 66) против 53,52% (n = 77) не неопластических. Образцы железистой ткани, включающие 138 экземпляров, показали долю неопластических поражений 45,65% (n = 63) против 54,35% (n = 75) не неопластических. Аспираты лимфатических узлов (274 образца) продемонстрировали более низкую долю неопластических поражений — 33,94% (n = 93) против не неопластических — 66,06% (n = 181). Образцы органов (всего 444) имели долю неопластических поражений 29,28% и долю не неопластических — 70,72% (n = 314). Слизистые оболочки, включающие 257 образцов, в основном состояли из не неопластических поражений, с долей неопластических 13,23% и 86,77% (n = 223) не неопластических. Жидкостные образцы, являвшиеся наименьшей группой исследования (96 экземпляров), продемонстрировали наименьшую частоту неопластических процессов — всего 1,04% и 98,96% (n = 95) не неопластических.
На рисунке 2 представлено распределение неопластических и не неопластических поражений по категориям в данном исследовании.
С целью выяснить, связана ли частота различных типов клеток с полом и возрастом в группе неопластических диагнозов, в таблице 2 приведено описательное резюме случаев различных типов неопластических поражений, классифицированных по их природе: опухоли из круглых клеток, мезенхимальные, эпителиальные и меланоцитарные опухоли.
Что касается пола, у самок была более высокая доля эпителиальных опухолей (38,01%), тогда как мезенхимальные поражения чаще встречались у самцов (42,86%). Круглоклеточные опухоли распределялись между полами примерно одинаково (31,12% у самок и 34,16% у самцов), а меланоцитарные опухоли встречались редко в обеих группах, составляя менее 1% случаев. Что касается возраста, среди 621 оценённого случая наибольшую частоту в целом имели опухоли из круглых клеток (35,99%), затем мезенхимальные поражения (32,49%), эпителиальные (31,09%) и меланоцитарные (0,42%). Круглоклеточные опухоли преобладали у животных в возрасте ≤1 года и >1 до ≤2 лет, составляя более 80% неопластических процессов в этих возрастных группах.
Напротив, эпителиальные и мезенхимальные поражения становились более распространёнными у старших животных, особенно в возрастных группах >10 до ≤15 лет и >15 лет, где эпителиальные опухоли составляли до 39,66% диагнозов (Таблица 2).
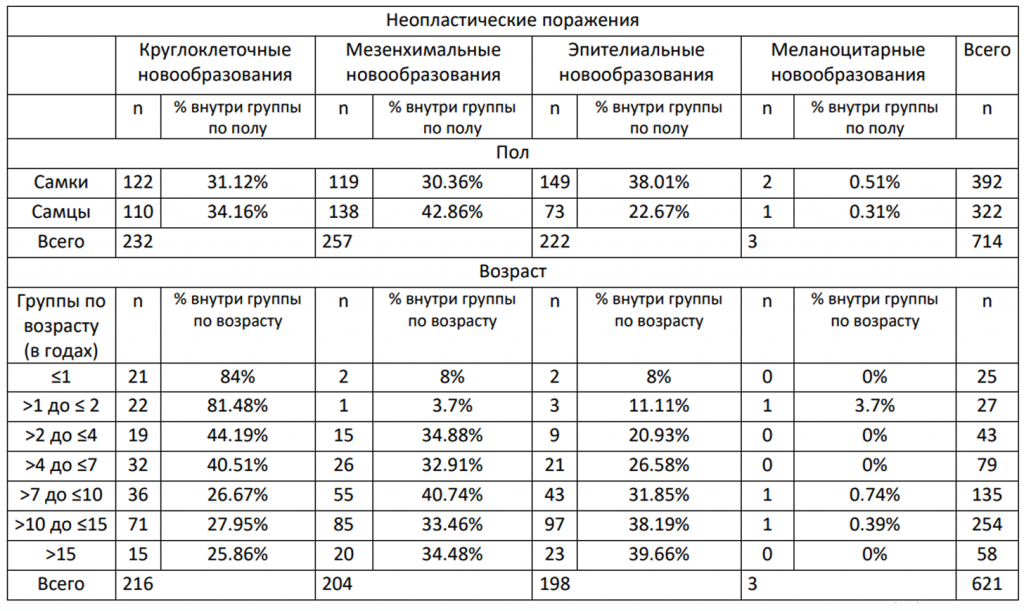
Таблица 1. Распределение не неопластических и неопластических поражений в зависимости от возрастной группы.
4. Обсуждение
В данном исследовании представлен всесторонний ретроспективный анализ цитологии как диагностического инструмента в ветеринарной медицине кошек за семилетний период. Анализ 3068 образцов из 130 ветеринарных клиник по всей Португалии показал диагностическую эффективность на уровне 66,20%, что подчёркивает важность цитологии в рутинной практике. Наши результаты согласуются с существующей литературой по применению цитологии в ветеринарной медицине, особенно в диагностике неопластических и не неопластических поражений. Хотя цитология широко признана за быстроту выполнения и доступность, остаются определённые ограничения, главным образом связанные с отсутствием тканевой архитектуры, качеством образцов и чувствительностью диагностики по сравнению с гистопатологией [5,28,33,34].
Цитология остаётся основным инструментом для предварительной оценки и классификации поражений, особенно с использованием тонкоигольной аспирации (FNA), которая даёт ценную информацию о клеточном составе [23]. Тем не менее, значительная часть образцов была классифицирована как недиагностическая, что соответствует результатам исследований у собак [38,39]. Факторами, способствовавшими этому, были недостаточная клеточность, гемодилюция и не оптимальная техника подготовки препаратов [18,21]. Несмотря на эти ограничения, цитология продемонстрировала высокую согласованность с гистопатологией для определённых типов поражений, особенно при выявлении круглоклеточных опухолей [5,40,41]. Тем не менее, эпителиальные и мезенхимальные неоплазии показали более высокий процент неубедительных цитологических диагнозов, что подтверждает рекомендацию проведения гистопатологического подтверждения в таких случаях [42]. Важно отметить, что, в отличие от других исследований, в данной работе цитологические диагнозы не подтверждались гистопатологией, поскольку основной целью исследования не являлась оценка точности цитологических исследований [2,15]. Следовательно, указанные факторы не следует интерпретировать как показатели повышенной диагностической надёжности, а скорее как переменные, повышающие вероятность того, что цитопатолог сможет дать клинически значимую интерпретацию [2].
В настоящем исследовании выявлены значительные различия в диагностической эффективности между анатомическими группами, что подчёркивает влияние происхождения образца на результаты цитологического исследования. Жидкостные образцы продемонстрировали наивысший уровень диагностической эффективности (83,48%), за ними следуют железистая ткань (76,67%) и слизистые оболочки (75,81%). Эти результаты согласуются с предыдущими исследованиями, которые отмечали высокую диагностическую результативность жидкостных образцов, обычно обладающих высокой клеточностью и хорошо сохраняющейся морфологией, что облегчает интерпретацию [43,44,45]. Аналогично, высокая результативность образцов слизистых оболочек и железистой ткани может объясняться относительной однородностью их клеточного состава, что повышает точность диагностики [24,25,46,47]. Образцы органов показали заметный уровень диагностической эффективности (67,79%), что соответствует данным предыдущих исследований, несмотря на присущие трудности при получении репрезентативных образцов из этих тканей [20,25,48]. Напротив, более низкие показатели были зарегистрированы для образцов категории «прочие» (66,98%), кожных и подкожных поражений (62,16%) и лимфатических узлов (57,93%). Эти результаты подтверждают данные предыдущих исследований [7,11,49], указывая на то, что кожные и подкожные образцы, несмотря на лёгкость их получения, подвержены артефактам, таким как гемодилюция, плохая сохранность клеток и воспалительное загрязнение, что может снижать точность диагностики. Диагностическая эффективность тонкоигольной аспирационной цитологии при оценке лимфатических узлов подчёркивает трудности, связанные с различением реактивной гиперплазии и неопластической инфильтрации, как было отмечено в предыдущих исследованиях [5,15,50]. Хотя цитология остаётся ценным инструментом для предварительной оценки, для окончательной классификации часто требуется гистопатологическое подтверждение, особенно в случаях с неоднозначными цитологическими признаками [24].
Недиагностические образцы составляли 33,80% от общего числа случаев, при этом наибольшие доли приходились на лимфатические узлы, кожные и подкожные поражения, а также категорию «прочие». Этот факт подчёркивает влияние ограничений, связанных с забором образцов, включая недостаточную клеточность, чрезмерное загрязнение кровью и некачественную подготовку препаратов. Учитывая значительную долю недиагностических случаев, оптимизация протоколов сбора и подготовки образцов является ключевым фактором для повышения диагностической ценности цитологии [18].
Статистически значимой связи между породой кошек и вероятностью возникновения неопластических поражений не выявлено, что указывает на относительно равномерное распределение неоплазий среди пород. Это наблюдение согласуется с существующими эпидемиологическими данными, показывающими, что хотя некоторые породы могут иметь генетическую предрасположенность, более значимыми факторами в развитии опухолей являются возраст и воздействие окружающей среды [51].
Аналогично, статистически значимой общей связи между полом и частотой возникновения неопластических поражений не выявлено, что указывает на сопоставимую распространённость неоплазий у самцов и самок. Однако более детальный анализ конкретных типов опухолей выявил заметные тенденции: эпителиальные и меланоцитарные неоплазии чаще диагностировались у самок, тогда как круглоклеточные опухоли и мезенхимальные поражения встречались чаще у самцов. Эти результаты согласуются с предыдущими исследованиями, показывающими, что гормональные воздействия и генетические факторы могут способствовать различиям в распределении опухолей между полами [51,52].
Известно, что некоторые типы опухолей у кошек демонстрируют различия по полу: например, опухоли молочных желёз значительно чаще встречаются у самок [30,47,52,53,54].
Сообщается, что некоторые опухоли, особенно мезенхимального происхождения, встречаются чаще у самцов, хотя механизмы этого явления остаются недостаточно изученными [47,54]. Аналогично, у самцов чаще диагностировались круглоклеточные опухоли, такие как лимфома, тучноклеточные опухоли и плазмоцитарные опухоли. Это согласуется с предыдущими исследованиями, указывающими на то, что у самцов может быть более высокий риск развития лимфомы, особенно в связи с инфекцией вирусом лейкоза кошек (FeLV), чему способствуют различия в иммунной функции и восприимчивости к ретровирусам [47,52]. За пределами неоплазий, цитологические диагнозы воспалительных и не неопластических состояний не показали породной предрасположенности. Однако предыдущие исследования указывают, что некоторые воспалительные состояния, например, эозинофильные гранулёмы, могут встречаться чаще у сиамских и других восточных пород из-за их специфических иммунных реакций [55,56]. Отсутствие общей половой предрасположенности к неоплазиям в данном исследовании согласуется с результатами предыдущих масштабных эпидемиологических исследований [47,52], которые рассматривают пол как незначительный фактор риска рака, за исключением гормонозависимых опухолей, таких как карцинома молочной железы. Тем не менее, наблюдаемые различия в подтипах опухолей между полами подчёркивают важность учета пола как потенциального фактора, влияющего на интерпретацию цитологических данных.
Настоящее исследование подтверждает хорошо известную связь между старением и увеличением частоты неопластических заболеваний у кошек. Совокупное воздействие канцерогенов окружающей среды, хронического воспаления и генетических мутаций способствует повышенному риску развития неоплазий у пожилых и старых животных [52,53]. Тем не менее, некоторые исследования оспаривают эту связь, указывая на то, что определённые типы опухолей не демонстрируют чёткой возрастной зависимости и могут встречаться чаще у молодых животных [51]. Хотя некоторые опухоли, например лимфомы, могут проявляться у молодых взрослых кошек, особенно у заражённых ретровирусами, такими как FeLV, широкое тестирование и вакцинация привели к снижению частоты этого типа лимфом, которые теперь чаще диагностируются у пожилых кошек без FeLV-инфекции [57]. Напротив, воспалительные и не неопластические поражения чаще встречались у молодых кошек, особенно при инфекционных процессах или иммунной реакции, таких как эозинофильные гранулёмы и пиогранулематозные воспаления.
Учитывая заметное увеличение числа неопластических диагнозов у стареющих кошек, эти данные подчёркивают важность проактивных диагностических стратегий, особенно у пожилых и старых животных. Регулярная цитологическая оценка подозрительных поражений, в сочетании с визуализационными методами и при необходимости гистопатологическим подтверждением, может способствовать раннему выявлению заболеваний и улучшению клинических исходов [18,28,58,59]. У молодых кошек ветеринарным врачам следует в первую очередь рассматривать воспалительные и реактивные процессы как основные дифференциальные диагнозы, прежде чем подозревать неоплазию. Наибольшее отношение шансов на развитие неопластических поражений наблюдалось у старых кошек (>15 лет), у которых риск развития неоплазий был почти в пять раз выше, чем в референтной группе. Это резкое увеличение риска рака дополнительно подтверждает необходимость тщательного наблюдения за неопластическими процессами у пожилых кошек [47,52,53,60].
5. Заключение
Исследование подчёркивает, что цитология является минимально инвазивным, быстрым и экономически эффективным методом выявления неопластических, воспалительных и не неопластических поражений, особенно в жидкостных, железистых и слизистых образцах, которые обеспечивают высокую диагностическую результативность. Однако высокая доля недиагностических образцов (33,80%) указывает на необходимость совершенствования протоколов забора и подготовки образцов, повышения квалификации операторов и стандартизации цитологических методов для улучшения диагностических результатов.
Диагностическая эффективность различалась в зависимости от анатомического расположения образцов, возраста и пола животных. У пожилых кошек отмечалась значительно более высокая частота неопластических заболеваний: у старых животных количество диагнозов неоплазий было почти в пять раз выше, чем у молодых, что указывает на необходимость скрининга с учётом возраста. Хотя связи между породой и развитием неоплазий выявлено не было, отмечены различия в зависимости от пола: у самок чаще встречались эпителиальные и меланоцитарные неоплазии, тогда как мезенхимальные и круглоклеточные опухоли преобладали у самцов, что указывает на возможное влияние генетических, гормональных и экологических факторов на развитие неопластических процессов у кошек.
Благодарности
Авторы выражают искреннюю благодарность лаборатории INNO Veterinary Laboratories (Брага, Португалия) за предоставленные результаты, которые способствовали проведению данного исследования.
Вклад авторов.
Концепция исследования: P.B.-S., R.M., J.P. и F.Q.; методология: P.B.-S., A.M. и F.Q.; программное обеспечение: P.B.-S., R.L., A.S. и Â.M.; валидация: P.B.-S., A.S., R.M., J.P. и F.Q.; формальный анализ: P.B.-S., R.L. и Â.M.; исследование: P.B.-S.; ресурсы: P.B.-S., A.S. и L.D.; кураторство данных: P.B.-S., R.L. и Â.M.; написание оригинальной версии рукописи: P.B.-S., R.L. и F.Q.; обзор и редактирование: P.B.-S., R.L., L.D., A.M., A.S., Â.M., R.M., J.P. и F.Q.; визуализация: P.B.-S. и R.L.; надзор: R.M., J.P. и F.Q.; управление проектом: R.M., J.P. и F.Q.; привлечение финансирования: Â.M., J.P. и F.Q. Все авторы ознакомились с опубликованной версией рукописи и согласны с ней.
Заявление об одобрении этического комитета.
Все процедуры соответствовали португальскому законодательству о защите животных, используемых в научных целях (Декрет-закон № 113/2013 от 7 августа 2013 года), которое транслирует европейское законодательство (Директива 2010/63/ЕС Европейского парламента и Совета от 22 сентября 2010 года). Проект исследования был одобрен Этическим комитетом INNO Veterinary Laboratories (коды протоколов INNO.007 и INNO.0026, утверждены 29 сентября 2021 года), что гарантирует возможность анонимного использования анализируемых образцов ветеринарных центров в рамках данного исследования и научных работ.
Заявление о получении информированного согласия.
Информированное согласие (устное или письменное) было получено от владельца или законного опекуна всех животных, описанных в данном исследовании (экспериментальные или неэкспериментальные животные, включая трупы, ткани и образцы), для всех проведённых процедур (проспективных или ретроспективных исследований). В публикации не представлены идентифицируемые животные или люди, поэтому дополнительное согласие на публикацию не требовалось.
Заявление о доступности данных.
Данные, представленные в этом исследовании, доступны по запросу у соответствующих авторов.
Конфликт интересов.
Авторы P.B.-S., L.D., A.M. и A.S. являются сотрудниками компании INNO Veterinary Laboratories (Брага, Португалия). Остальные авторы заявляют, что исследование проводилось без каких-либо коммерческих или финансовых отношений, которые могли бы рассматриваться как потенциальный конфликт интересов.
Оригинальный текст статьи доступен по ссылке.
Список литературы
1. Bonfanti U., Bertazzolo W., Gracis M., Roccabianca P., Romanelli G., Palermo G., Zini E. Diagnostic value of cytological analysis of tumours and tumour-like lesions of the oral cavity in dogs and cats: A prospective study on 114 cases. Vet. J. 2015;205:322–327.
2. Sapierzyński R., Czopowicz M., Ostrzeszewicz M. Factors affecting the diagnostic utility of canine and feline cytological samples. J. Small Anim. Pract. 2017;58:73–78.
3. Sharkey L.C., Seelig D.M., Overmann J. All lesions great and small, part 2. Diagnostic cytology in veterinary medicine. Diagn. Cytopathol. 2014;42:544–552.
4. Sharkey L.C., Seelig D.M., Overmann J. All lesions great and small, part 1: Diagnostic cytology in veterinary medicine. Diagn. Cytopathol. 2014;42:535–543.
5. Ku C.K., Kass P.H., Christopher M.M. Cytologic-histologic concordance in the diagnosis of neoplasia in canine and feline lymph nodes: A retrospective study of 367 cases. Vet. Comp. Oncol. 2017;15:1206–1217.
6. Ayele L., Mohammed C., Yimer L. Review on diagnostic cytology: Techniques and applications in veterinary medicine. J. Vet. Sci. Technol. 2017;8:2.
7. MacNeill A. Cytology of canine and feline cutaneous and subcutaneous lesions and lymph nodes. Top. Companion Anim. Med. 2011;26:62–76.
8. Blanchet C., Fish E., Miller A., Snyder L., Labadie J., Avery P. Evaluation of Region of Interest Digital Cytology Compared to Light Microscopy for Veterinary Medicine. Vet. Pathol. 2019;56:725–731.
9. Coleto A.F., De Almeida Moreira T., Gundim L., De Almeida Silva S., Castro M., Bandarra M., Ronchi A.M. Perfil de exames citológicos, sensibilidade e especificidade da punção por agulha fina em amostras cutâneas e subcutâneas em cães. Braz. J. Vet. Med. 2016;38:311–315.
10. Allen B., Evans S. Diagnostic accuracy of cytology for the detection of bacterial infection in fluid samples from veterinary patients. Vet. Clin. Pathol. 2022;51:252–257.
11. Ghisleni G., Roccabianca P., Ceruti R., Stefanello D., Bertazzolo W., Bonfanti U., Caniatti M. Correlation between fine-needle aspiration cytology and histopathology in the evaluation of cutaneous and subcutaneous masses from dogs and cats. Vet. Clin. Pathol. 2006;35:24–30.
12. Fisher D.J. Cutaneous and subcutaneous lesions. In: Valenciano A.C., Cowell R.L., editors. Diagnostic Cytology and Hematology of the Dog and Cat. 5th ed. Elsevier; Amsterdam, The Netherlands: 2020. pp. 74–101.
13. Fisher K.J., Meyer D.J. Acquisition and Management of Cytologic Specimens. In: Raskin R.E., Meyer D.J., Boes K.M., editors. Canine and Feline Cytopathology: A Color Atlas and Interpretation Guide. 4th ed. Elsevier; St. Louis, MO, USA: 2023. pp. 1–14.
14. Meinkoth J.H., Cowell R.L., Tyler R.D., Morton R.J. Cowell and Tyler’s Diagnostic Cytology and Hematology of the Dog and Cat. 5th ed. Elsevier; Amsterdam, The Netherlands: 2020. Sample Collection and Preparation; pp. 1–17.
15. Amores-Fuster I., Cripps P., Graham P., Marrington A.M., Blackwood L. The diagnostic utility of lymph node cytology samples in dogs and cats. J. Small Anim. Pract. 2015;56:125–129.
16. Rodolfo F.A., Colodel M.M., Rocha N.S. Cytological examination in veterinary medicine: Retrospective study of 11,468 cases (1994–2008). Pesq. Vet. Bras. 2012;32:1169–1173.
17. Masserdotti C. Architectural patterns in cytology: Correlation with histology. Vet. Clin. Pathol. 2006;35:388–396.
18. Whitlock J., Taeymans O., Monti P. A comparison of cytological quality between fine-needle aspiration and non-aspiration techniques for obtaining ultrasound-guided samples from canine and feline lymph nodes. Vet. Rec. 2021;188\:e25.
19. Dolka I., Czopowicz M., Gruk-Jurka A., Wojtkowska A., Sapierzyński R., Jurka P. Diagnostic efficacy of smear cytology and Robinson’s cytological grading of canine mammary tumors with respect to histopathology, cytomorphometry, metastases and overall survival. PLoS ONE. 2018;13\:e0191595.
20. Liffman R., Courtman N. Fine needle aspiration of abdominal organs: A review of current recommendations for achieving a diagnostic sample. J. Small Anim. Pract. 2017;58:599–609.
21. Fleming K.L., Howells E.J., Villiers E.J., Maddox T.W. A randomised controlled comparison of aspiration and non-aspiration fine-needle techniques for obtaining ultrasound-guided cytological samples from canine livers. Vet. J. 2019;252:105372.
22. Heinrich D.A., Avery A.C., Henson M.S., Overmann J.A., Rendahl A.K., Walz J.Z., Seelig D.M. Cytology and the cell block method in diagnostic characterization of canine lymphadenopathy and in the immunophenotyping of nodal lymphoma. Vet. Comp. Oncol. 2019;17:365–375.
23. Arai S., Rist P., Clancey N., Gilroy C., Stryhn H., Amsellem P. Fine-needle aspiration of cutaneous, subcutaneous, and intracavitary masses in dogs and cats using 22- vs 25-gauge needles. Vet. Clin. Pathol. 2019;48:287–292.
24. Brilhante-Simões P., Delgado L., Martins Â., Silva A., Monteiro L., Marcos R., Prada J. Association Between Cytological and Histopathological Diagnoses of Neoplastic and Non-Neoplastic Lesions in Oral Cavity from Dogs and Cats: An Observational Retrospective Study of 103 Cases. Vet. Sci. 2025;12:75.
25. Wypij J.M. Getting to the point: Indications for fine-needle aspiration of internal organs and bone. Top. Companion Anim. Med. 2011;26:77–85.
26. Wang S.-L., Lee J.-J., Liao A.T. Comparison of cytological and histopathological validation on fine needle aspiration of superficial masses. Taiwan Vet. J. 2014;40:191–198.
27. Ballegeer E.A., Forrest L.J., Dickinson R.M., Schutten M.M., Delaney F.A., Young K.M. Correlation of ultrasonographic appearance of lesions and cytologic and histologic diagnoses in splenic aspirates from dogs and cats: 32 cases (2002–2005). J. Am. Vet. Med. Assoc. 2007;230:690–696.
28. McAloney C.A., Sharkey L.C., Feeney D.A., Seelig D.M. Diagnostic utility of renal fine-needle aspirate cytology and ultrasound in the cat. J. Feline Med. Surg. 2018;20:544–553.
29. Martins D.B., Rossato C.K., Silva S.L., Almeida S.S.N., Ribeiro L.S. Fine needle aspiration cytology in feline skeletal muscle as a diagnostic tool for extramedullary plasmacytoma. Arq. Bras. Med. Vet. Zootec. 2017;69:587–592.
30. Gregório H., Pires I., Seixas F., Queiroga F. Mammary invasive micropapillary carcinoma in a male cat: Immunohistochemical description and clinical follow-up. Acta Vet. Hung. 2012;60:257–261.
31. Villamil J.A., Henry C.J., Bryan J.N., Ellersieck M., Schultz L., Tyler J.W., Hahn A.W. Identification of the most common cutaneous neoplasms in dogs and evaluation of breed and age distributions for selected neoplasms. J. Am. Vet. Med. Assoc. 2011;239:960–965.
32. Raskin R. General Categories of Cytologic Interpretation. In: Raskin R.E., Meyer D.J., Boes K.M., editors. Canine and Feline Cytopathology: A Color Atlas and Interpretation Guide. 4th ed. Elsevier; St. Louis, MO, USA: 2023. pp. 15–34.
33. Christopher M.M., Ku C.K. Likelihood of Neoplasia for Diagnoses Modified by Probability Terms in Canine and Feline Lymph Node Cytology: How Probable Is Probable? Front. Vet. Sci. 2018;5:246.
34. Isaza D., Robinson N., Pizzirani S., Pumphrey S. Evaluation of cytology and histopathology for the diagnosis of feline orbital neoplasia: 81 cases (2004–2019) and review of the literature. Vet. Ophthalmol. 2020;23:682–689.
35. Ho N.T., Smith K.C., Dobromylskyj M.J. Retrospective study of more than 9000 feline cutaneous tumours in the UK: 2006–2013. J. Feline Med. Surg. 2018;20:128–134.
36. Skeldon N., Dewhurst E. The perceived and actual diagnostic utility of veterinary cytological samples. J. Small Anim. Pract. 2009;50:180–185.
37. Rishniw M., Freeman K.P. Veterinary clinicians prefer template-style reports with personal confidence estimates for cytologic sample evaluations. J. Am. Vet. Med. Assoc. 2024;262:513–519.
38. Tecilla M., Gambini M., Forlani A., Caniatti M., Ghisleni G., Roccabianca P. Evaluation of cytological diagnostic accuracy for canine splenic neoplasms: An investigation in 78 cases using STARD guidelines. PLoS ONE. 2019;14\:e0224945.
39. Sabattini S., Renzi A., Buracco P., Defourny S., Garnier-Moiroux M., Capitani O., Bettini G. Comparative Assessment of the Accuracy of Cytological and Histologic Biopsies in the Diagnosis of Canine Bone Lesions. J. Vet. Intern. Med. 2017;31:864–871.
40. Auch C.L., Michael A. Cutaneous plasmacytoma with Mott cell differentiation in a dog. J. Vet. Diagn. Investig. 2024;36:564–568.
41. Johnson M.C., Myers A.N. Cytology of Skin Neoplasms. Vet. Clin. North. Am. Small Anim. Pract. 2017;47:85–110.
42. Ipek V., Cangul I.T., Akkoc A. Comparative Evaluation of the Cytological, Histopathological and Immunohistochemical Findings of Canine Cutaneous and Subcutaneous Masses. Acta Vet. 2021;71:61–84.
43. Fernandes N., Guerra J., Réssio R., Wasques D., Etlinger-Colonelli D., Lorente S., Nogueira E., Dagli M. Liquid-based cytology and cell block immunocytochemistry in veterinary medicine: Comparison with standard cytology for the evaluation of canine lymphoid samples. Vet. Comp. Oncol. 2016;14(Suppl. S1):107–116.
44. Prickett J.R., Zimmerman J.J. The development of oral fluid-based diagnostics and applications in veterinary medicine. Anim. Health Res. Rev. 2010;11:207–216.
45. Luo Y., She D.L., Xiong H., Yang L., Fu S.J. Diagnostic Value of Liquid-Based Cytology in Urothelial Carcinoma Diagnosis: A Systematic Review and Meta-Analysis. PLoS ONE. 2015;10\:e0134940.
46. Eördögh R., Schwendenwein I., Tichy A., Nell B. Impression cytology: A novel sampling technique for conjunctival cytology of the feline eye. Vet. Ophthalmol. 2015;18:276–284.
47. Graf R., Grüntzig K., Hässig M., Axhausen K.W., Fabrikant S., Welle M., Meier D., Guscetti F., Folkers G., Otto V., et al. Swiss Feline Cancer Registry: A Retrospective Study of the Occurrence of Tumours in Cats in Switzerland from 1965 to 2008. J. Comp. Pathol. 2015;153:266–277.
48. Oblak M.L., Lu H.Y., Ram A.S., McKenna C. Comparative aspects of targeted sentinel lymph node mapping in veterinary and human medicine: Opportunities for future research. Front. Med. 2024;11:1342456.
49. Mello C.B.E., Engelmann A., Kommers G., Flores M.M., Fighera R.A., Rodrigues B.R., Lamego É.C., Da Silva C.B., Bueno A., De Andrade C.M. Fine needle aspiration cytology: High accuracy in diagnosing cutaneous and subcutaneous neoplasms in dogs. Comp. Clin. Pathol. 2022;32:155–164.
50. Beer P., Pozzi A., Rohrer Bley C., Bacon N., Pfammatter N.S., Venzin C. The role of sentinel lymph node mapping in small animal veterinary medicine: A comparison with current approaches in human medicine. Vet. Comp. Oncol. 2018;16:178–187.
51. Huber D., Ristevski T., Kurilj A., Maurić M., Zagradišnik L., Hohšteter M., Šoštarić-Zuckermann I. Prevalence of pathological lesions diagnosed by cytology in cats, with association of diagnosis to age, breed and gender. Vet. Arhiv. 2021;91:169–177.
52. Graf R., Grüntzig K., Boo G., Hässig M., Axhausen K.W., Fabrikant S., Welle M., Meier D., Guscetti F., Folkers G., et al. Swiss Feline Cancer Registry 1965–2008: The Influence of Sex, Breed and Age on Tumour Types and Tumour Locations. J. Comp. Pathol. 2016;154:195–210.
53. Huber D., Severin K., Vlahović D., Križanac S., Mofardin S., Buhin I.M., Zagradišnik L.M., Šoštarić-Zuckermann I.-C., Kurilj A.G., Artuković B., et al. Cancer morbidity in Croatian cats: Retrospective study on spontaneously arising tumors (2009–2019). Top. Companion Anim. Med. 2024;58:100841.
54. Morris J. Mammary Tumours in the Cat: Size matters, so early intervention saves lives. J. Feline Med. Surg. 2013;15:391–400.
55. Omelchenko H., Avramenko N., Kulynych S., Petrenko M., Volosovets V., Volosovets N., Woźniakowski G. Some aspects of the diagnosis and treatment of eosinophilic granuloma in cats. J. Vet. Res. 2023;67:619–626.
56. Falcão F., Faísca P., Viegas I., de Oliveira J.T., Requicha J.F. Feline oral cavity lesions diagnosed by histopathology: A 6-year retrospective study in Portugal. J. Feline Med. Surg. 2020;22:977–983.
57. Rolph K.E., Cavanaugh R.P. Infectious Causes of Neoplasia in the Domestic Cat. Vet. Sci. 2022;9:467.
58. Turner R., Liffman R., Woodward A., Beck C., Courtman N., Dandrieux J. Assessment of the clinical usefulness of ultrasound-guided cytological specimens obtained from gastrointestinal lesions in dogs and cats. J. Small Anim. Pract. 2021;62:114–122.
59. Vignoli M., Tamburro R., Felici A., Del Signore F., Dettori A., Di Tommaso M., Ghiraldelli A., Terragni R., Simeoni F., Falerno I., et al. Clinical Value of CT-Guided Fine Needle Aspiration and Tissue-Core Biopsy of Thoracic Masses in the Dog and Cat. Animals. 2021;11:883.
60. Ludwig L., Dobromylskyj M., Wood G.A., van der Weyden L. Feline Oncogenomics: What Do We Know about the Genetics of Cancer in Domestic Cats? Vet. Sci. 2022;9:547.

