5 причин нерегенеративной анемии у кошек и собак

Анемия – это снижение гематокрита, гемоглобина и/или концентрации эритроцитов, что приводит к снижению способности крови переносить кислород. А это, в свою очередь, может привести к неспецифическим клиническим признакам, например, летаргии, непереносимости физических нагрузок, депрессии. Анемия обычно классифицируется как регенеративная или нерегенеративная на основе реакции костного мозга.
Регенеративная анемия подозревается, если она вызвана потерей эритроцитов из-за кровотечения или гемолиза. Регенерация обычно становится очевидной в общем анализе крови (за счёт ретикулоцитоза) в течение 3–5 дней с момента начала кровотечения или гемолиза.
Пререгенеративная анемия может быть предположена, если пациент оценивается до истечения 3 дней, и клинические данные свидетельствуют о том, что костный мозг отреагирует.
Отсутствие ретикулоцитоза в течение 5–7 дней после начала анемии указывает на нерегенеративную анемию, поскольку прошло достаточно времени для регенеративного ответа костного мозга.
Определение причины нерегенеративной анемии может быть сложной задачей, поскольку существует множество потенциальных этиологий. Ниже приведены 5 основных патологий, которые могут привести к нерегенеративной анемии.
Анемия воспаления
Анемия воспаления (ранее анемия хронического заболевания) является частой причиной лёгкой или умеренной нерегенеративной анемии, обычно характеризующейся нормоцитарной, нормохромной морфологией эритроцитов с небольшим или отсутствующим сопутствующим пойкилоцитозом.
Любое хроническое заболевание, вызывающее длительную системную воспалительную реакцию, может привести к нерегенеративной анемии. Патогенез анемии воспаления можно объяснить нарушением метаболизма железа, нарушением функции костного мозга или сокращением продолжительности жизни эритроцитов.
При ненарушенном метаболизме железа старые эритроциты фагоцитируются тканевыми макрофагами. Затем железо транспортируется из макрофагов через связанный с мембраной белок (ферропортин) для повторного использования в эритропоэзе.
Транспорт через ферропортин необходим для выхода железа из макрофага. Гепсидин, белок острой фазы воспаления, уровень которого повышается в ответ на циркулирующие воспалительные цитокины (в первую очередь интерлейкин-6 и интерлейкин-1), связывается с ферропортином и вызывает его интернализацию и деградацию, захватывая железо внутри макрофагов тканей. Поэтому железо недоступно при анемии воспаления, несмотря на нормальные или повышенные общие запасы железа в организме.
Хотя нарушение метаболизма железа инициирует анемию воспаления, недавние исследования на собаках и мышах показали, что концентрация гепсидина увеличивается только на начальных стадиях воспаления, что позволяет предположить, что могут играть роль и другие факторы.
Исследования на крысах и людях показали, что цитокины могут ингибировать выработку эритропоэтина (ЭПО; гормон, вырабатываемый перитубулярной интерстициальной тканью в почках), а также опосредованную ЭПО дифференциацию и пролиферацию предшественников эритроидных клеток.
Исследований по концентрации ЭПО в сыворотке у собак мало. Исследования на кошках показывают, что притупление реакции эритроцитов на ЭПО и/или ингибирование дифференциации предшественников эритроцитов может способствовать поддержанию анемического состояния больше, чем концентрация ЭПО в сыворотке.
Исследования на собаках и кошках с экспериментально вызванными абсцессами показывают, что хроническое системное воспаление может сократить продолжительность жизни эритроцитов.
Преждевременное удаление эритроцитов посредством макрофагального эритрофагоцитоза является результатом активации макрофагов, вызванной воспалительными цитокинами, и покрытия эритроцитов иммуноглобулином.
Анемия хронического заболевания почек
Анемия хронического заболевания почек (ХЗП/анемия почечной недостаточности) – частая причина нерегенеративной анемии, обычно характеризующейся нормоцитарной, нормохромной морфологией эритроцитов. Может быть лёгкой, умеренной или тяжёлой в зависимости от стадии ХЗП.
Распространённость увеличивается с возрастом пациента, особенно у кошек (до 80% у пожилых кошек). Дефицит ЭПО является основной этиологией анемии ХБП.
У здоровых пациентов с недостаточной оксигенацией тканей гипоксия-индуцируемый фактор-1 альфа (HIF-1 альфа) стимулирует повышение выработки ЭПО для увеличения концентрации эритроцитов, что увеличивает способность переносить кислород и возвращает организм в негипоксическое состояние.
Правильная оксигенация приводит к деградации HIF-1 альфа и снижению выработки и высвобождения ЭПО. ХБП приводит к прогрессирующему разрушению перитубулярных интерстициальных клеток, что приводит к недостаточной выработке ЭПО, несмотря на повышенный HIF-1 альфа.
По мере прогрессирования ХБП выработка эритроцитов снижается с дальнейшей потерей почечной функции и разрушением ткани, вырабатывающей ЭПО, в почках.
Исследование на собаках показало сильное снижение гематокрита и высокий процент собак без признаков регенерации (<60 000 ретикулоцитов/мкл) по мере прогрессирования ХБП до стадии 4 по классификации Международного общества по изучению заболеваний почек.
Другие факторы, например, нарушение почечного клиренса и хроническое воспаление, также способствуют развитию анемии у пациентов с почечной недостаточностью. Почки не способны эффективно фильтровать и удалять метаболиты, накопление которых может привести к уремии.
У собак и кошек уремия может повысить хрупкость эритроцитов, что может привести к преждевременному или повышенному выведению эритроцитов. Также предполагается, что уремия пагубно влияет на коагуляцию, что может способствовать анемии из-за потери крови через язвы пищеварительного тракта, вызванные уремией.
Гормонально-ассоциированная анемия
Эндокринопатии, особенно гипотиреоз и гипоадренокортицизм, являются гормональными нарушениями, которые могут вызывать нерегенеративную анемию (обычно у собак), характеризующуюся лёгкой формой с нормоцитарной, нормохромной морфологией эритроцитов.
Гормон щитовидной железы играет много важных ролей в организме, включая поддержание нормального гематокрита. Пациенты с гипотиреозом имеют более низкую скорость метаболизма (по сравнению со здоровыми пациентами), что приводит к снижению потребления энергии и потребности в кислороде.
Собаки с нерегенеративной анемией, связанной с гипотиреозом, обычно имеют сниженные концентрации ЭПО, что может указывать на адаптацию к выработке меньшего количества ЭПО в ответ на анемию из-за снижения скорости метаболизма и снижения физиологической потребности в кислороде.
С другой стороны, некоторые исследования предполагают, что снижение продукции эритроцитов может быть связано с уменьшением продукции ЭПО, снижением реакции на ЭПО и снижением прямого воздействия ЭПО на ранние гемопоэтические плюрипотентные стволовые клетки в результате снижения уровня гормона щитовидной железы. Необходимы дополнительные исследования, чтобы чётко определить задействованные механизмы.
Механизм нерегенеративной анемии при гипоадренокортицизме до конца не изучен. Нормальная продукция кортикостероидов и андрогенов, вероятно, влияет на стимуляцию эритропоэза в костном мозге. Наоборот, недостаток этих гормонов, вероятно, снижает выработку ЭПО.
Продолжающиеся потери жидкости могут маскировать тяжесть анемии, но могут быть обнаружены после инфузионной терапии. Сопутствующее кровотечение из пищеварительного тракта также может усугубить анемию.
Иммуноопосредованная нерегенеративная анемия
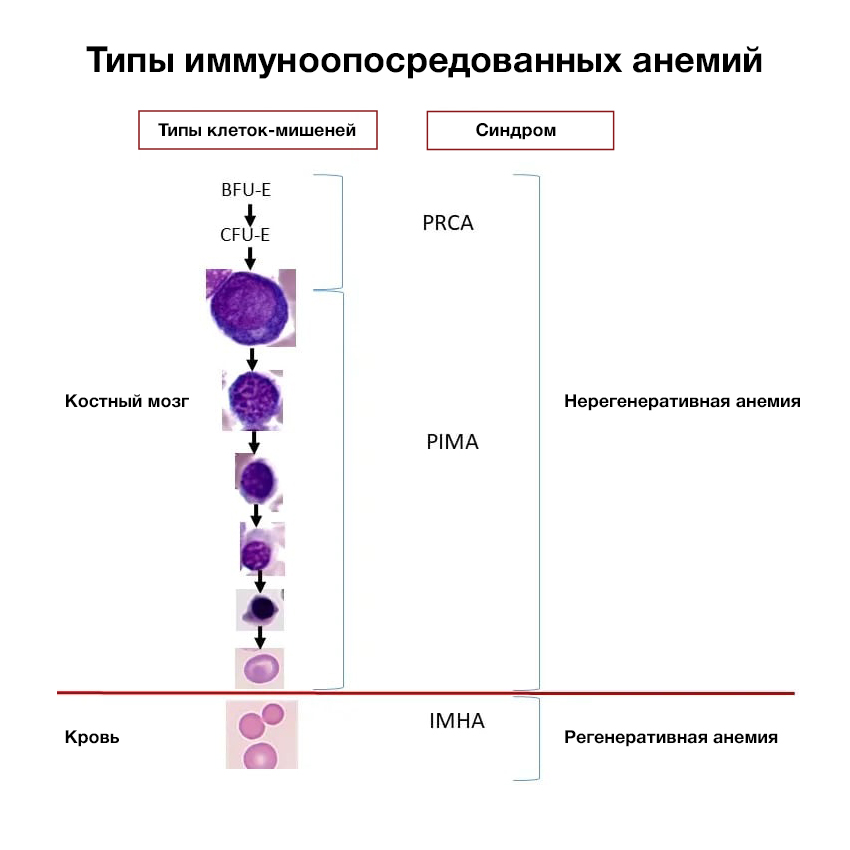
Иммуноопосредованные нерегенеративные анемии (парциальная красноклеточная аплазия костного мозга [PRCA], иммуноопосредованная анемия предшественников [PIMA]) приводят к стойкой анемии с отсутствием ретикулоцитоза.
В отличие от иммуноопосредованной гемолитической анемии (IMHA), которая является хорошо изученным расстройством, характеризующимся иммуноопосредованным нацеливанием на зрелые эритроциты, что приводит к регенеративной анемии, механизмы действия и патогенезы PRCA и PIMA чётко не определены.
Однако PRCA и PIMA классифицируются как иммуноопосредованные расстройства, поскольку современные данные подтверждают идиопатическое иммуноопосредованное уничтожение эритроидных предшественников, и эти пациенты обычно реагируют на иммуносупрессивную терапию и рецидивируют после прекращения терапии.
PRCA и PIMA обычно приводят к тяжёлым, нормоцитарным, нормохромным, нерегенеративным анемиям. Морфологические изменения эритроцитов не ожидаются при исследовании мазка крови у пациентов с PRCA. Напротив, у пациентов с PIMA макроцитоз и эллиптоцитоз (овалоциты) являются обычным явлением. Однако отсутствие этих морфологий эритроцитов не исключает PIMA.
При PRCA мегакариоциты и гранулоцитарные предшественники не затронуты. Таким образом, концентрации тромбоцитов и нейтрофилов обычно находятся в пределах референтного интервала – признак, который отличает PRCA от апластической анемии. В некоторых случаях PIMA сообщалось о других сопутствующих цитопениях, например, нейтропении, тромбоцитопении.
У здоровых пациентов первой стадией эритропоэза является прогениторная бурстобразующая эритроидная единица (BFU-E), которая дифференцируется в колониеобразующую эритроцидную единицу (CFU-E). CFU-E производит дополнительные клетки-предшественники, причём каждый CFU-E даёт от 8 до 32 зрелых эритроцитов.
У пациентов с иммуноопосредованными анемиями определённая стадия (или стадии) эритроцитов является целью для уничтожения, и заболевание классифицируется на основе целевой стадии или группы стадий.
У пациентов с IMHA зрелые эритроциты являются целью иммунной системы и уничтожаются. У пациентов с PRCA разрушаются BFU-E, CFU-E или ранние рубрибласты, что приводит к отсутствию идентифицируемой эритроидной линии при обычном исследовании костного мозга. PIMA возникает в результате воздействия на любую стадию после CFU-E/раннего рубрибласта и до зрелых эритроцитов, от рубрибласта до ретикулоцита.
Базальный эритропоэз заменяет естественно умирающие эритроциты у здоровых пациентов. У пациентов с PIMA или PRCA иммуноопосредованное разрушение предшественников эритроцитов приводит к неспособности заменить естественно умирающие эритроциты. Этот неэффективный эритропоэз вызывает постепенное снижение гематокрита, и анемия развивается медленно, давая организму время адаптироваться к состоянию пониженной доступности кислорода.
Таким образом, эти анемии обычно становятся тяжёлыми к тому времени, когда у пациента проявляются неспецифические клинические признаки, например, летаргия, анорексия, бледные слизистые оболочки.
Для окончательной диагностики PIMA и PRCA требуется оценка костного мозга. При PIMA обнаружение в костном мозге неэффективного эритропоэза характеризуется расширенной популяцией предшественников (эритроидная гиперплазия) вплоть до стадии клеток, которые являются мишенью и которые удаляются (часто называемой остановкой созревания). При PRCA исследование костного мозга выявляет редкие или не выявляет эритроидных предшественников.
Миелофтизная анемия (объёмные поражения)
Миелофтиз относится к любому состоянию, которое приводит к неэффективному производству нормальных линий клеток в костном мозге, вызванному заменой нормальной ткани костного мозга (или среды) аномальной тканью.
Замена костного мозга аномальной тканью приводит к недостаточности костного мозга и неспособности проводить нормальный гемопоэз. Пациенты обычно имеют сочетание нерегенеративной анемии, нейтропении и/или тромбоцитопении.
Миелофтизная анемия чаще всего наблюдается при первичных или вторичных инфильтративных неопластических заболеваниях, миелофиброзе или гранулёмах костного мозга, вызванных инфекционными организмами. Анемия может быть последней цитопенией, которая развивается из-за большей продолжительности жизни эритроцитов по сравнению с тромбоцитами и гранулоцитами.
Хотя любое новообразование, которое пролиферирует в ткани костного мозга, может потенциально вызвать миелофтизную анемию, лимфоидная неоплазия является частой причиной миелофтиза.
У этих пациентов часто наблюдается обширная пролиферация неопластической клеточной линии, которая уничтожила нормальную структуру и функцию ткани костного мозга. Тромбоцитопения и лейкопения могут помочь дифференцировать миелофтиз как причину нерегенеративной анемии от паранеопластической нерегенеративной анемии, вызванной хроническим воспалением или опухолевой инфильтрацией с разрушением почек. Однако для окончательной диагностики миелофтиза необходимо исследование костного мозга.
Формирование гранулёмы было зарегистрировано при многих заболеваниях, включая бактериальные, риккетсиозные, грибковые, паразитарные и вирусные инфекции. В этих случаях диссеминированные инфекционные агенты, например, Leishmania spp, Histoplasma spp, могут спровоцировать гранулёматозное воспаление и образование гранулёмы в костном мозге, что в конечном итоге приводит к миелофтизу и недостаточности костного мозга.
При миелофиброзе пролиферация фибробластов, коллагеновых или ретикулиновых волокон в кроветворном пространстве обычно связана с умеренной или тяжёлой нерегенеративной анемией.
Первичный миелофиброз (миелопролиферативное заболевание) редко подтверждается у собак и кошек, но вторичный миелофиброз встречается относительно часто.
Основной патогенез вторичного миелофиброза не совсем понятен, но может быть вызван обширным повреждением костного мозга с последующим образованием рубцовой ткани.
Повреждение микрососудов может привести к тяжёлой ишемии, которая вызывает миелонекроз, который может привести к миелофиброзу, особенно при хроническом заболевании.
Пациенты с миелофиброзом обычно имеют умеренную или тяжёлую нерегенеративную анемию с тромбоцитопенией или без нее и лейкопенией (реже). Миелофиброз обычно обратим, если основное заболевание выявлено и вылечено. Причины миелофиброза включают ИОГА, острый лейкоз или лимфому, миелотоксическое лечение у собак и ИОГА, ХБП, ФИП и острый миелоидный лейкоз у кошек.
Заключение
Подтверждённые случаи анемии следует определять как:
▪️ регенеративные (присутствует адекватный ретикулоцитоз);
▪️ пререгенеративные (недостаточно времени для видимого ответа костного мозга);
▪️ нерегенеративные (отсутствие ретикулоцитоза после того, как анемия присутствовала в течение 5-7 дней).
Хотя нерегенеративная анемия имеет много причин, анемия воспаления является наиболее распространённой причиной у кошек и собак и должна быть исключена в первую очередь, особенно в случаях лёгкой анемии.
Автор перевода: Майя Зарщикова, ветеринарный врач общеклинического отдела ветеринарной лаборатории «ПОИСК»
Источник: по ссылке

